Forskere opdager, hvordan kropstemperatur ødelægger potentiel dengue, Zika-vaccine
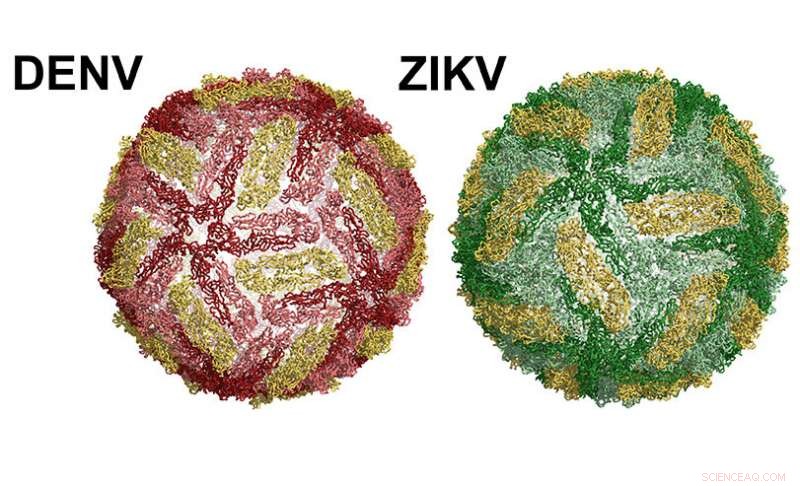
En dengue-viruspartikel til venstre. Zika til højre. Kredit:UNC School of Medicine
En vigtig vej mod at skabe effektive vacciner mod dengue-virus og Zika involverer E-proteinet, der dækker overfladen af hver viral partikel. Hvis vi kunne udvikle stærke antistoffer mod dette E-protein, så ville det være kernen i en formidabel vaccine – baseret på det vigtige faktum, at 180 E-proteinerne kommer i par. Men at skabe sådan en vaccine har vist sig vanskelig af en række årsager. Nu har UNC School of Medicine-forskere afgrænset detaljerne i en stor barriere for en lovende vaccine. Det er noget, vi alle har - en naturlig kropstemperatur på omkring 98,6 grader.
Tidligere undersøgelser i Aravinda de Silvas laboratorium har vist, at mennesker skaber stærke antistoffer mod E-proteinet på virusoverfladen, tyder på, at en opløselig version af E-proteinet (kaldet sRecE) kunne være en god vaccine. Desværre, indtil videre er det ikke lykkedes, og vacciner baseret på sRecE har fejlet. UNC-forskere ledet af Brian Kuhlman, Ph.D., professor i biokemi og biofysik, og Aravinda de Silva, Ph.D., professor i mikrobiologi og immunologi, har vist, at kropstemperatur reducerer parringstilbøjeligheden af sRecE og dets evne til at blive genkendt af disse stærke antistoffer.
Disse fund, offentliggjort i Journal of Biological Chemistry , tyder på, at stabilisering af parringstilbøjeligheden af sRecE kan være afgørende for at skabe en effektiv vaccine.
"Vi har vist, hvordan vores naturlige kropstemperatur undergraver sRecE-styrken, og hvordan fremtidig sRecE-baseret vaccineudvikling skal tage højde for temperaturen fra begyndelsen, " sagde UNC kandidatstuderende Stephan Kudlacek, den første forfatter på JBC papir.
Efter årtiers intens forskning, udvikling af dengue- og zikavirusvacciner har haft begrænset succes. Disse myggebårne flavivirus er et stort folkesundhedsproblem. Mere end 50 procent af verdens befolkning er i risiko for infektion, hundreder af millioner mennesker er smittet, og en stor procentdel af dem står over for alvorlige, svækkende symptomer. Dengue-infektion kan føre til livstruende hæmoragisk sygdom. I mellemtiden det nylige Zika-udbrud har sat Zika-infektion i forbindelse med alvorlige neurologiske lidelser, mikrocefali hos spædbørn og Guillain-Barrés syndrom hos voksne. Af disse grunde, vaccineudviklingen er blevet øget for at beskytte mod både dengue og Zika.
Vaccineudvikling er udfordrende, fordi der er fire forskellige serotyper eller "smag" af dengue, og en vaccine skal yde lige stor beskyttelse mod hver af dem. Også, en vaccine skal skabes sådan, at den ikke fremmer immunsystemet til at danne antistoffer, der genkender, men ikke kan neutralisere virussen. Hvis det sker, dengue og Zika kan bruge disse antistoffer til at inficere immunsystemets celler og gøre infektionen mere alvorlig - dette kaldes antistofafhængig forbedring.
Dette iboende problem er grunden til, at Dengvaxia – den eneste licenserede vaccine mod dengue – nu kun anbefales til brug hos personer med delvis immunitet over for dengue opnået fra en tidligere dengueinfektion, fordi vaccinen ser ud til at øge risikoen for alvorlig sygdom, når den bruges til personer, der har aldrig været udsat for virussen, og vaccinen giver delvis beskyttelse mellem de forskellige dengue-serotyper.
Overfladen af dengue- og Zika-viruspartikler er strukturelt ens. Begge vira er belagt med et enkelt protein - kaldet kappeproteinet (E). Hver virus indeholder 180 kopier af E-proteinet på overfladen, i par af to, kendt som homodimerer. En opløselig version af E-proteinet, kaldet sRecE, kan danne den samme homodimer struktur observeret af E-proteiner på overfladen af viruset. Dengue- og Zika-inficerede patienter udvikler neutraliserende og beskyttende antistoffer, der retter sig mod specifikke regioner på E-proteinet kaldet epitoper. Denne viden har fået forskere til at teste, om E-proteinet eller sRecE kan fungere som effektive vacciner. Desværre, sRecE-baserede vacciner har fungeret dårligt.
Andre forskere har opdaget, at mange af de mest potente neutraliserende antistoffer isoleret fra humane patienter binder til epitoper, der er til stede på E-protein-homodimeren på overfladen af virussen, mens de svagt neutraliserende antistoffer, der fremmer sygdomsforstærkning, binder til et sted på E-proteinmonomeren - en enkelt kopi af E-proteinet, kendt som fusionsløkken. En særlig klasse af de potente antistoffer kaldet E Dimer Epitope (EDE) antistoffer genkender påfaldende en region af E-proteinet i både dengue og Zika. Disse antistoffer er i stand til at neutralisere alle fire dengue-serotyper og Zika. Disse opdagelser tyder på, at for at skabe effektive vacciner, det vil være vigtigt at konstruere antigener, der præsenterer disse nyopdagede dimerepitoper.
Dimer-specifikke epitoper kunne være den mest ligetil at skabe, hvis du bruger rekombinante proteiner som sRecE. Og det er blevet foreslået, at sRecE homodimerer kan fungere som effektive vacciner.
Men undersøgelser har antydet, at vores naturlige kropstemperatur på 98,6 grader ændrer E-proteinets evne til at parre sig og danne homodimerer på virusoverfladen. Da sRecE er et lovende antigen til vaccineudvikling, og da stabiliteten af sRecE-homodimeren er vigtig for at præsentere dimere antistofepitoper såsom EDE til vaccination, Kuhlman og de Silvas laboratorier søgte at forstå, hvordan temperaturen påvirker stabiliteten af sRecE-proteinet og dets evne til at danne homodimerer.
"Vi brugte en række biofysiske teknikker til at besvare disse spørgsmål." sagde Kudlacek. "Som typisk observeret, vi fandt ud af, at koldere temperaturer hjælper med at holde proteiner i deres oprindelige eller aktive struktur. På grund af dette, vi testede derefter for at se, hvordan sRecE fra tre dengue-serotyper og i Zika kan danne homodimerer, som det ses på overfladen af virussen, i buffer ved stuetemperatur."
UNC-forskerne opdagede, at dengue og Zika sRecE danner homodimerer ved stuetemperatur. "Men da vi lavede eksperimentet ved fysiologisk temperatur [98?F], alle sRecE'er - inklusive dengue serotype 2 (DENV2) og Zika sRecE homodimerer - faldt fra hinanden og blev til monomerer. Dette resultat viste, at de fysiologiske temperatur-inducerede E-proteinændringer observeret på virusoverfladen også forekommer i sRecE." Yderligere analyse viste, at DENV2 sRecE's evne til at danne homodimerer ved kropstemperatur er reduceret 150 gange sammenlignet med evnen til at danne homodimerer ved stuetemperatur.
Forskerne undrede sig så:da sRecE-dimerisering reduceres ved fysiologisk temperatur, er antistoffer, der specifikt genkender E-dimeren, i stand til at binde til dengue og Zika sRecE ved fysiologisk temperatur? De testede dette og fandt ud af, at dengue- og Zika sRecE-homodimererne faldt fra hinanden ved 98,6F, eliminerer således de dimere epitoper, der er til stede i sRecE-homodimeren, og reducerer antistofbinding.
"Vores resultater viser, at ved kropstemperatur, tilstedeværelsen af dengue og Zika sRecE homodimerer er stærkt reduceret, og tilstedeværelsen af sRecE monomer øges, " sagde Kudlacek. "Dette giver en forklaring på, hvorfor tidligere sRecE-baserede vaccinestrategier har fungeret dårligt, da kropstemperatur favoriserer monomer sRecE, dermed fokusere immunsystemet på at generere mere svagt neutraliserende antistoffer, som kan resultere i sygdomsforstærkning, snarere end at producere potent neutraliserende dimer-specifikke antistoffer."
Til fremtidig sRecE-baseret vaccineudvikling, dette arbejde tyder på, at sRecE-homodimeren skal omkonstrueres for at være stabil ved kropstemperatur, så immunsystemet kan generere E-dimer-specifikke antistoffer, der er stærke nok til at beskytte mod sygdom i stedet for at forstærke den.
 Varme artikler
Varme artikler
-
 Cool touch skjorter kan få dig til at føle dig kølig på varme dage, men hvilke materialer funger…Forsiden (venstre) og bagsiden (højre) side af et jersey strikmateriale har forskellige effusivitetsegenskaber. Kredit:Jeremy Stangeland, CC BY-ND Det er endnu en varm og svedig sommerdag, og du s
Cool touch skjorter kan få dig til at føle dig kølig på varme dage, men hvilke materialer funger…Forsiden (venstre) og bagsiden (højre) side af et jersey strikmateriale har forskellige effusivitetsegenskaber. Kredit:Jeremy Stangeland, CC BY-ND Det er endnu en varm og svedig sommerdag, og du s -
 Store forhåbninger til new-age gummi:Selvreparerende materiale har mange industrielle anvendelserEt diagram over den nye gummipolymer. Kredit:Flinders University Forestil dig en selvreparerende gummi, eller superklæbende fremstillet udelukkende af affaldsmaterialer. Det lyder som science fic
Store forhåbninger til new-age gummi:Selvreparerende materiale har mange industrielle anvendelserEt diagram over den nye gummipolymer. Kredit:Flinders University Forestil dig en selvreparerende gummi, eller superklæbende fremstillet udelukkende af affaldsmaterialer. Det lyder som science fic -
 Foto-responsive proteinhydrogeler som middel til kontrolleret frigivelse af stamceller/proteinerMaterialedesign styrket af proteinsekvensrum. Kredit:Institut for Kemisk og Biologisk Teknik, HKUST Hydrogels, kendt for deres biomimetiske egenskaber, er de førende materialer til biomedicinske a
Foto-responsive proteinhydrogeler som middel til kontrolleret frigivelse af stamceller/proteinerMaterialedesign styrket af proteinsekvensrum. Kredit:Institut for Kemisk og Biologisk Teknik, HKUST Hydrogels, kendt for deres biomimetiske egenskaber, er de førende materialer til biomedicinske a -
 Ny screeningsmetode udviklet til at bekræfte, om deuteration forbedrer metabolisk stabilitetBilledtekst:(Venstre) Metabolsk assay i en gryde af en 1:1 blanding af deutereret og ikke-deutereret molekyle. (Højre) overvågningssignaler ved tandem MS for begge analoger (blå og røde søjler). En af
Ny screeningsmetode udviklet til at bekræfte, om deuteration forbedrer metabolisk stabilitetBilledtekst:(Venstre) Metabolsk assay i en gryde af en 1:1 blanding af deutereret og ikke-deutereret molekyle. (Højre) overvågningssignaler ved tandem MS for begge analoger (blå og røde søjler). En af


