DNA -enzym blander cellemembraner tusind gange hurtigere end dets naturlige modstykke
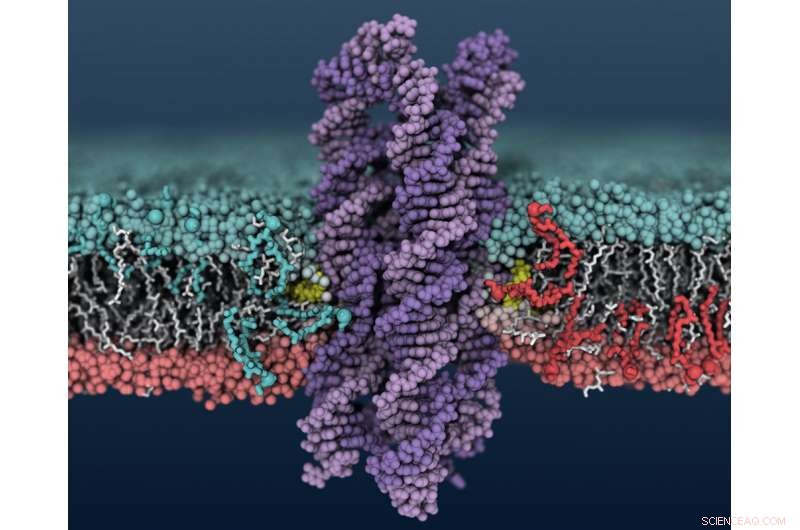
Et syntetisk DNA -enzym indsættes i en cellemembran, får lipider til at blande sig mellem de indre og ydre membranlag. Kredit:Christopher Maffeo
Et nyt syntetisk enzym, fremstillet af DNA frem for protein, vender lipidmolekyler i cellemembranen, udløser en signalvej, der kan udnyttes til at fremkalde celledød i kræftceller.
Forskere ved University of Illinois i Urbana-Champaign og University of Cambridge siger, at deres lipid-krypterende DNA-enzym er det første i sin klasse, der overgår naturligt forekommende enzymer-og gør det i tre størrelsesordener. De offentliggjorde deres resultater i tidsskriftet Naturkommunikation .
"Cellemembraner er foret med et andet sæt molekyler på indersiden og ydersiden, og celler bruger mange ressourcer på at opretholde dette, "sagde studieleder Aleksei Aksimentiev, en professor i fysik i Illinois. "Men på nogle punkter i en celles liv, asymmetrien skal skilles ad. Så bliver markørerne, der var indeni, udenfor, som sender signaler til bestemte processer, såsom celledød. Der er enzymer i naturen, der gør det kaldet scramblases. Imidlertid, ved nogle sygdomme, hvor scramblaser er mangelfulde, dette sker ikke korrekt. Vores syntetiske scramblase kan være en vej til terapeutiske midler. "
Aksimentievs gruppe kom på DNA's scramblase -aktivitet, da de så på DNA -strukturer, der danner porer og kanaler i cellemembraner. De brugte Blue Waters -supercomputeren på National Center for Supercomputing Applications i Illinois til at modellere systemerne på atomniveau. De så, at når visse DNA -strukturer indsættes i membranen - i dette tilfælde, et bundt med otte DNA -tråde med kolesterol i enderne af to af strengene - lipider i membranen omkring DNA'et begynder at blande sig mellem de indre og ydre membranlag.
For at kontrollere scramblase -aktiviteten, som computermodellerne forudsiger, Aksimentievs gruppe i Illinois indgik et samarbejde med professor Ulrich Keysers gruppe i Cambridge. Cambridge -gruppen syntetiserede DNA -enzymet og testede det i modelmembranbobler, kaldet vesikler, og derefter i humane brystkræftceller.
"Resultaterne viser meget endegyldigt, at vores DNA -nanostruktur faktisk letter hurtig lipid -kryptering, sagde Alexander Ohmann, en kandidatstuderende i Cambridge og en medforfatter af papiret sammen med Illinois kandidatstuderende Chen-Yu Li. "Mest interessant, den høje vendehastighed, der er angivet ved molekylære dynamiksimuleringer, synes at være af samme størrelsesorden i eksperimenter:op til tusind gange hurtigere end det, der tidligere er blevet vist for naturlige scramblaser. "
På egen hånd, DNA -scramblase producerer celledød uden forskel, Sagde Aksimentiev. Det næste trin er at koble det til målretningssystemer, der specifikt opsøger bestemte celletyper, hvoraf en række allerede er udviklet til andre DNA -midler.
"Vi arbejder også på at få disse scramblase -strukturer aktiveret af lys eller anden stimulans, så de kun kan aktiveres efter behov og kan slukkes, "Sagde Aksimentiev.
"Selvom vi stadig har en lang vej at gå, dette arbejde fremhæver det enorme potentiale for syntetiske DNA -nanostrukturer med mulige anvendelser til tilpassede lægemidler og terapier til en række sundhedsmæssige forhold i fremtiden, "Sagde Ohmann.
 Varme artikler
Varme artikler
-
 Titaniumatom, der findes to steder på én gang i krystal, skyld i usædvanligt fænomenDette højopløselige scanningselektronmikroskop (SEM) billede af BaTiS 3 krystaller er overlejret med illustrationer, der viser orienteringen af individuelle atomer i krystallen. På trods af krysta
Titaniumatom, der findes to steder på én gang i krystal, skyld i usædvanligt fænomenDette højopløselige scanningselektronmikroskop (SEM) billede af BaTiS 3 krystaller er overlejret med illustrationer, der viser orienteringen af individuelle atomer i krystallen. På trods af krysta -
 Elbilbatterier inspirerer til sikrere, billigere måde at fremstille forbindelser, der bruges i medi…Forskere ved Scripps Research, inspireret af disse batteriers raffinerede elektrokemi, har udviklet et batterilignende system, der giver dem mulighed for at gøre potentielle fremskridt inden for frems
Elbilbatterier inspirerer til sikrere, billigere måde at fremstille forbindelser, der bruges i medi…Forskere ved Scripps Research, inspireret af disse batteriers raffinerede elektrokemi, har udviklet et batterilignende system, der giver dem mulighed for at gøre potentielle fremskridt inden for frems -
 Polymerer springer gennem bøjler på vej til bæredygtige materialerKemisk og biomolekylær ingeniørprofessor Charles Schroeder, venstre, og kandidatstuderende Yuecheng (Peter) Zhou studerer flowdynamikken i ring- og lineære polymerløsninger for at aflæse spor om, hvor
Polymerer springer gennem bøjler på vej til bæredygtige materialerKemisk og biomolekylær ingeniørprofessor Charles Schroeder, venstre, og kandidatstuderende Yuecheng (Peter) Zhou studerer flowdynamikken i ring- og lineære polymerløsninger for at aflæse spor om, hvor -
 Accelereret analyse af stabiliteten af komplekse legeringerProfessor dr. Alfred Ludwig, Dr. Yujiao Li, Alan Savan og dr. Aleksander Kostka (fra forside til bagside). Kredit:RUB, Marquard Materialeforskere ved Ruhr-Universität Bochum er i stand til at afgø
Accelereret analyse af stabiliteten af komplekse legeringerProfessor dr. Alfred Ludwig, Dr. Yujiao Li, Alan Savan og dr. Aleksander Kostka (fra forside til bagside). Kredit:RUB, Marquard Materialeforskere ved Ruhr-Universität Bochum er i stand til at afgø
- Airbnb tilføjer getaways i overensstemmelse med dyreriget
- Nanopartikler kommer ind på hjernetumorer, øge nøjagtigheden af kirurgisk fjernelse
- Superbugs kan udløse vores næste globale finanskrise
- USA er den største kulstofudleder i historien. Hvor står andre nationer?
- Anonym Twitter-trold dømt for overgreb i Belgien
- Første glimt af, hvordan gamle Denisovans kan have set ud, ved hjælp af DNA-methyleringsdata


