Et chaperonin protein, GroEL, har en mere kompleks mekanisme, end man troede før
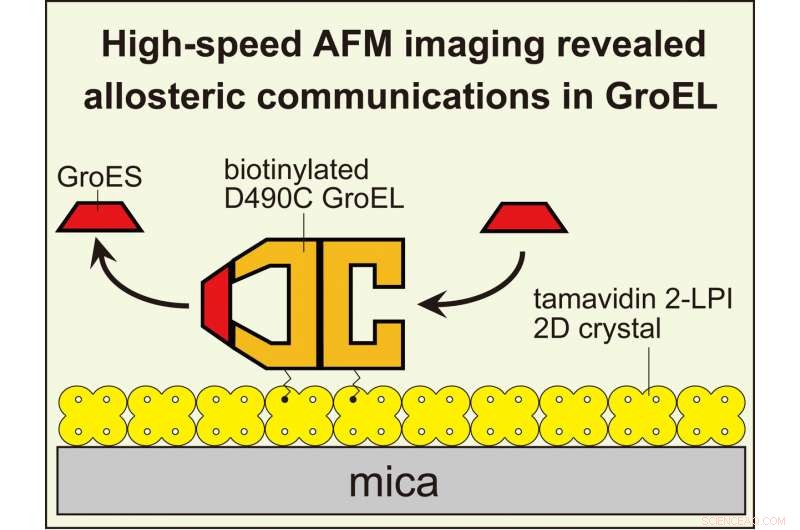
HS-AFM-billeddannelse afslørede allosterisk interring-kommunikation i GroEL, der styrer dens chaperoninreaktion. For at visualisere dynamiske GroEL-GroES-interaktioner med højhastigheds AFM, GroEL biotinyleret ved dets ækvatoriale domæner blev bundet til den todimensionelle krystal af tamavidin 2-LPI, der var direkte dannet på glimmeroverfladen. Kredit:Kanazawa University
Proteiner skal foldes på en bestemt måde for at fungere. Dette er ofte assisteret af molekylære chaperoner - små proteiner, hvis opgave er at hjælpe andre med at folde til den rigtige form. Nu, Japanske forskere har opdaget, at for en molekylær chaperone i det mindste, der er mere i processen, end der var mistanke om.
I et papir i Philosophical Transactions of the Royal Society , den Kanazawa-ledede gruppe fokuseret på GroEL, som er afgørende for proteinfoldning i bakterier. Den grove oversigt forstås:GroEL fanger et udfoldet målprotein (substratet) i et hulrum, hvor den kan foldes korrekt uden at samle sig. Imidlertid, de mekanistiske detaljer er svære at optrevle med traditionelle ensemblemetoder. I den nye undersøgelse, højhastigheds atomkraftmikroskopi (HS-AFM) blev brugt til at visualisere begivenheder mere direkte.
GroEL er et cylinderformet molekyle, lavet af to ringe stablet ryg mod ryg. En nøglepartner i dens funktion er GroES, en ringformet "co-chaperonin", der binder sig til hver ende af GroEL som et hvælvet låg. Kun når GroEL er begrænset af GroES, kan det fange substratproteinet. Derefter, når foldningen er færdig, GroES tager afstand fra GroEL, og det foldede substrat frigives.
Hvor det bliver diset er, hvordan de to ringe i hver ende af GroEL samarbejder. Ringene er identiske, og begge kan begrænses af GroES. Når kun den ene ende er lukket, det resulterende kompleks kaldes en "kugle", i kraft af sit spidse udseende. I mellemtiden formen med begge ender lukkede kaldes en "fodbold", da dens symmetriske ovale form ligner en gitterkugle.

GroES association og dissociation begivenheder fanget af HS-AFM billeddannelse. Selvom reaktionen hovedsageligt forløber på en alternativ måde som B? ? F ? B? ? F (B og F repræsenterer kugle- og fodboldkomplekser, henholdsvis, og de lodrette pile angiver polariteten af kuglekomplekser), det forekommer af og til på forskellige måder. Kredit:Kanazawa University
"I en konventionel model, cyklus af dækning, proteinfoldning, og afdækning skifter mellem hver ring, " siger undersøgelsens medforfatter Daisuke Noshiro. "Capping ved den ene ring af GroEL (som har cis stereokemi) forhindrer samtidig afdækning i den anden (trans) ende. Sådan intramolekylær kommunikation er kendt som allosteri." I denne opfattelse, den enkeltstående kugle er den aktive form for GroEL, og fodbold er blot en kortvarig mellemting mellem cyklusser.
Andre fund, selvom, har antydet større kompleksitet - hvilket er blevet fremhævet af denne nye undersøgelse. Afhængigt af underlagstypen, GroEL optrådte som en fodbold, snarere end en kugle, op til 67 % af tiden, indebærer en nedbrydning af negativ allosterisk regulering. Dette var mest almindeligt, når substratet var et udfoldeligt protein, eller der slet ikke var noget substrat, men selv med foldbare underlag, fodboldkomplekser bugnede.
Mere uventet, cyklussen foregik ad to forskellige veje. I den overvejende type I, når den aktive ring af GroEL fuldfører sin opgave, og den anden ende tager stafetten, de to ringe udveksler også cis- og transkonformationer. Imidlertid, omkring 25 % af tiden (i type II), konformationerne udveksles ikke, forstyrre cirkulæret, skiftende rytme af type I. Ikke desto mindre, proteinfoldning forekommer stadig. Fodbolde er udbredt i begge tilfælde.
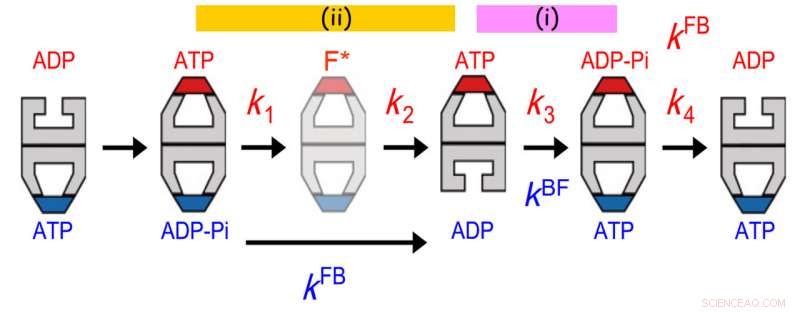
Allosterisk kommunikation mellem to ringe af GroEL. Levetidsfordelingen af bundet GroES var bedst tilpasset til en sekventiel firetrins reaktionsmodel med fire hastighedskonstanter, k1, k2, k3 og k4. Værdien af k3 stemte overens med værdien af kugle-til-fodbold overgangen (kBF) i den modsatte ring. I øvrigt, værdien af 1/k1 + 1/k2 stemmer overens med værdien af 1/kFB (kFB, hastigheden af fodbold-til-kugle overgangen i den modsatte ring). Den tidligere aftale indikerer, at ATP-hydrolyse til ADP-Pi på en ring fungerer som en tidsholder for ADP-frigivelse fra den modsatte transring, sikring af frigivelsen af substratprotein fra trans-ringen, før den lukkes med GroES. Sidstnævnte aftale indikerer, at en hændelse, der opstår i andet trin efter ATP-binding, udløser Pi-frigivelse fra den modsatte ring. Kredit:Kanazawa University
"Fodboldstrukturen er så rigelig, det må spille en mere aktiv rolle, end vi troede, " siger den tilsvarende forfatter Toshio Ando. "Denne komplekse mekanisme er vigtig, fordi chaperoniner er en naturlig klasse af molekylære maskiner. Finesserne i GroEL kan hjælpe os til at forstå rollen af allosteri i molekylære maskiner mere generelt."
Sidste artikelCRISPRs vokseværk
Næste artikelForskere bruger fotoner til at adskille metalioner
 Varme artikler
Varme artikler
-
 XenonPy.MDL:Et omfattende bibliotek af fortrænede modeller til materialeegenskaberTermofysiske egenskaber (dvs. termisk ledningsevne) af polymerer forudsagt af transfer learning (TL). Den fælles forskergruppe lykkedes med at konstruere en maskinlæringsmodel, der er i stand til ekst
XenonPy.MDL:Et omfattende bibliotek af fortrænede modeller til materialeegenskaberTermofysiske egenskaber (dvs. termisk ledningsevne) af polymerer forudsagt af transfer learning (TL). Den fælles forskergruppe lykkedes med at konstruere en maskinlæringsmodel, der er i stand til ekst -
 Forskere udvikler boblediameter forudsigelsesmodel til industriel brug(a) Typisk billeddannelsesbillede; (b) Rationel validering af den foreslåede forudsigelseskorrelation. Kredit:HUANG Qingshan Gas-væske og gas-væske-fast reaktorer er blevet brugt i vid udstrækning
Forskere udvikler boblediameter forudsigelsesmodel til industriel brug(a) Typisk billeddannelsesbillede; (b) Rationel validering af den foreslåede forudsigelseskorrelation. Kredit:HUANG Qingshan Gas-væske og gas-væske-fast reaktorer er blevet brugt i vid udstrækning -
 Slikker en Tootsie Roll -sensor for at overvåge sundhedEn elektrode fremstillet med en støbt Tootsie Roll og aluminiumsrør kan hjælpe med at overvåge ægløsningstilstand og nyresundhed. Kredit:Tilpasset fra ACS Applied Materials &Interfaces 2021 Engang
Slikker en Tootsie Roll -sensor for at overvåge sundhedEn elektrode fremstillet med en støbt Tootsie Roll og aluminiumsrør kan hjælpe med at overvåge ægløsningstilstand og nyresundhed. Kredit:Tilpasset fra ACS Applied Materials &Interfaces 2021 Engang -
 Forskere udvikler billige sensorer, der kan registrere COVID-19 i spildevandKredit:CC0 Public Domain Forskere fra University of Strathclyde og Indian Institute of Technology (IIT) Bombay har demonstreret en billig sensor, der kan detektere fragmenter af den virus, der er
Forskere udvikler billige sensorer, der kan registrere COVID-19 i spildevandKredit:CC0 Public Domain Forskere fra University of Strathclyde og Indian Institute of Technology (IIT) Bombay har demonstreret en billig sensor, der kan detektere fragmenter af den virus, der er
- High-speed og on-silicium-chip graphene blackbody emittere
- Undersøgelse viser, at en bemærkelsesværdig høj andel af nationale valg ikke er frie og fair
- Fremtidige biler kan fremstilles af revolutionerende nyt materiale
- Jordens vitale tegn forværres, efterhånden som menneskehedens påvirkning bliver dybere
- Sværmbaseret simuleringsstrategi viser sig væsentligt kortere
- Mikrober kan vokse på nitrogenoxid


