Hvad er sjældne jordarters grundstoffer? Fire spørgsmål besvaret

En håndfuld europium. Kredit:Alchemist-hp, CC BY-SA
De fleste amerikanere bruger sjældne jordarters grundstoffer hver dag – uden at vide det, eller ved noget om, hvad de laver. Det kan ændre sig, da disse usædvanlige materialer er ved at blive et omdrejningspunkt i den eskalerende handelskrig mellem USA og Kina.
Stanley Mertzman, en geolog, hvis speciale er røntgenanalyse af sten og mineraler for at bestemme deres kemiske sammensætning, og som underviser i mineralogi på Franklin and Marshall College, forklarer mere om disse lidt kendte og fascinerende elementer - og den moderne elektronik, de muliggør.
1. Hvad er sjældne jordarters grundstoffer?
Strengt taget, de er grundstoffer ligesom andre i det periodiske system - såsom kulstof, brint og oxygen – med atomnumre 57 til 71. Der er to andre med lignende egenskaber, som nogle gange er grupperet med dem, men de vigtigste sjældne jordarters grundstoffer er de 15. For at lave den første, lanthan, start med et bariumatom og tilføj en proton og en elektron. Hvert på hinanden følgende sjældne jordarters grundstof tilføjer en mere proton og en mere elektron.
Det er væsentligt, at der er 15 sjældne jordarters grundstoffer:Kemistuderende kan huske, at når elektroner føjes til et atom, de samles i grupper eller lag, kaldet orbitaler, som er som koncentriske cirkler af et mål omkring kernens ydre øje.
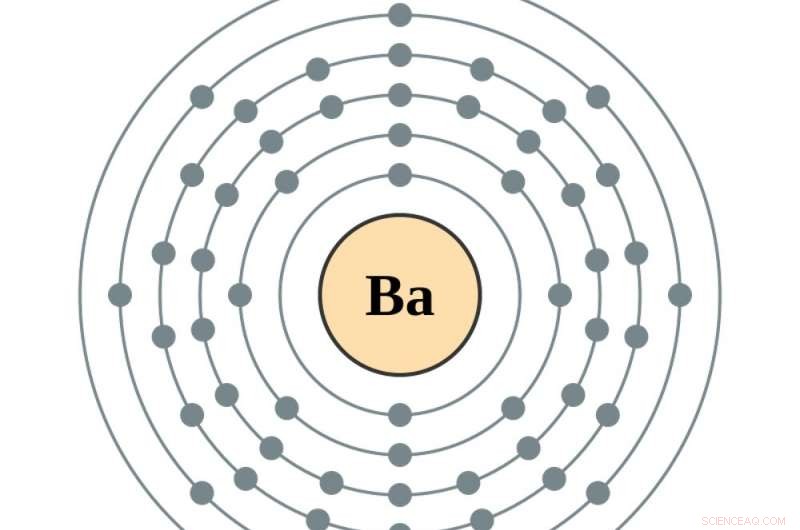
Et elektrondiagram af et bariumelement, det sidste grundstof før lanthanide sjældne jordarters grundstoffer. Kredit:Greg Robson og Pumbaa, CC BY-SA
Den inderste målcirkel af ethvert atom kan indeholde to elektroner; at tilføje en tredje elektron betyder at tilføje en i den anden målcirkel. Det er der, de næste syv elektroner går, også – hvorefter elektroner skal gå til den tredje målcirkel, som kan rumme 18. De næste 18 elektroner går ind i den fjerde målcirkel.
Så begynder tingene at blive lidt mærkelige. Selvom der stadig er plads til elektroner i den fjerde målcirkel, de næste otte elektroner går ind i den femte målcirkel. Og på trods af mere plads i den femte, de næste to elektroner derefter går ind i den sjette målcirkel.
Det er når atomet bliver til barium, atomnummer 56, og de tomme pladser i tidligere målcirkler begynder at fylde. Tilføjelse af en elektron mere - for at lave lanthan, den første i rækken af sjældne jordarters grundstoffer – sætter den elektron i den femte cirkel. Tilføjelse af en anden, at lave cerium, atomnummer 58, tilføjer en elektron til den fjerde cirkel. At lave det næste element, praseodym, flytter faktisk den nyeste elektron i den femte cirkel til den fjerde, og tilføjer en mere. Derfra, yderligere elektroner fylder den fjerde cirkel.
I alle elementer, elektronerne i den yderste cirkel påvirker i høj grad grundstoffets kemiske egenskaber. Fordi de sjældne jordarter har identiske yderste elektronkonfigurationer, deres egenskaber er ret ens.
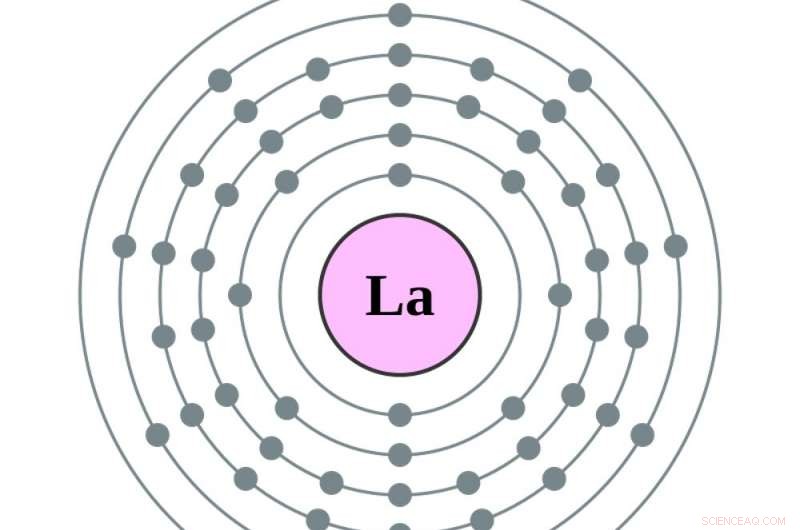
Et elektrondiagram af et lanthanatom, med en elektron mere i sin femte orbital end barium. Kredit:Greg Robson og Pumbaa, CC BY-SA
2. Er sjældne jordarters grundstoffer virkelig sjældne?
Nej. De er meget mere rigelige i jordskorpen end mange andre værdifulde grundstoffer. Selv den sjældneste sjældne jordart, thulium, med atomnummer 69, er 125 gange mere almindelig end guld. Og den mindst sjældne sjældne jordart, cerium, med atomnummer 58, er 15, 000 gange mere rigeligt end guld.
De er sjældne på én måde, dog - mineraloger ville kalde dem "spredning, " hvilket betyder, at de for det meste drysses over planeten i relativt lave koncentrationer. Sjældne jordarter findes ofte i sjældne magmatiske bjergarter kaldet karbonatitter - intet så almindeligt som basalt fra Hawaii eller Island, eller andesit fra Mount St. Helens eller Guatemalas Volcano Fuego.
Der er nogle få regioner, der har masser af sjældne jordarter – og de er for det meste i Kina, som producerer mere end 80 procent af den globale årlige total på 130, 000 tons. Australien har også et par områder, ligesom nogle andre lande. USA har en lille smule område med masser af sjældne jordarter, men den sidste amerikanske kilde for dem, Californiens Mountain Pass Quarry, lukket i 2015.
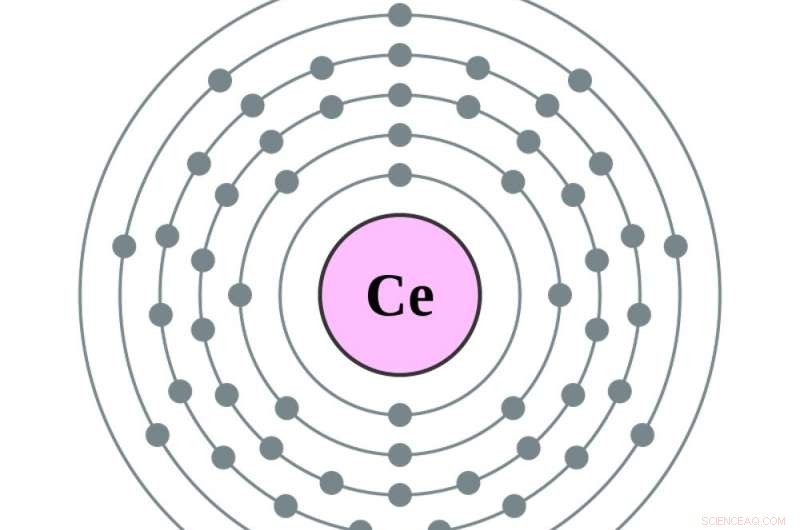
Cerium har en elektron mere i sin femte orbital og en mere i sin fjerde end barium. Kredit:Greg Robson og Pumbaa, CC BY-SA
3. Hvis de ikke er sjældne, er de meget dyre?
Ja, temmelig. I 2018, omkostningerne for et oxid af neodym, atomnummer 60, er 107 USD, 000 pr. ton. Prisen forventes at stige til $150, 000 inden 2025.
Europium er endnu dyrere – omkring $712, 000 pr. ton.
En del af årsagen er, at sjældne jordarters grundstoffer kan være kemisk svære at adskille fra hinanden for at få et rent stof.

Det sjældneste sjældne jordart, thulium. Kredit:Jurii, CC BY
4. Hvad er sjældne jordarters grundstoffer nyttige til?
I sidste halvdel af det 20. århundrede, europium, med atomnummer 63, kom i stor efterspørgsel efter sin rolle som farveproducerende fosfor i videoskærme, herunder computerskærme og plasma-tv. Det er også nyttigt til at absorbere neutroner i atomreaktorers kontrolstænger.
Andre sjældne jordarter er også almindeligt anvendt i elektroniske enheder i dag. Neodym, atomnummer 60, for eksempel, er en kraftig magnet, nyttige i smartphones, fjernsyn, lasere, genopladelige batterier og harddiske. En kommende version af Teslas elbilmotor forventes også at bruge neodym.
Efterspørgslen efter sjældne jordarter er steget støt siden midten af det 20. århundrede, og der er ingen reelle alternative materialer til at erstatte dem. Lige så vigtig som sjældne jordarter er for et moderne teknologibaseret samfund, og hvor svære de end er at mine og bruge, toldkampen kan sætte USA et meget dårligt sted, gør både landet og sjældne jordarters elementer til bønder i dette spil økonomisk skak.

En terning af små neodymmagneter. Kredit:XRDoDRX, CC BY-SA
Denne artikel blev oprindeligt publiceret på The Conversation. Læs den originale artikel. 
 Varme artikler
Varme artikler
-
 Flydende støddæmpereKredit:Swiss National Science Foundation Bemærkelsesværdige flydende materialer kaldet kolloider stivner under stød. Forskere finansieret af Swiss National Science Foundation har undersøgt virknin
Flydende støddæmpereKredit:Swiss National Science Foundation Bemærkelsesværdige flydende materialer kaldet kolloider stivner under stød. Forskere finansieret af Swiss National Science Foundation har undersøgt virknin -
 Udpegning af biomolekyler med nanometer nøjagtighedNanometer nøjagtighed i fjernfelts fluorescenslokaliseringsmikroskopi af to fluoroforer bundet til begge ender af 30 basepar af et dobbeltstrenget DNA (dsDNA) molekyle blev demonstreret ved at bruge k
Udpegning af biomolekyler med nanometer nøjagtighedNanometer nøjagtighed i fjernfelts fluorescenslokaliseringsmikroskopi af to fluoroforer bundet til begge ender af 30 basepar af et dobbeltstrenget DNA (dsDNA) molekyle blev demonstreret ved at bruge k -
 Forskere udvikler ikke-ædellegeringskatalysator til kanelaldehyd(en). Skematisk illustration af synteseproceduren for FeXCo@NC; (b). TEM-billede (indsæt:TEM-billede med høj forstørrelse og Fe-Co NPs størrelsesfordeling); (c) XRD-mønster; (d-e) HAADF-STEM, tilsvare
Forskere udvikler ikke-ædellegeringskatalysator til kanelaldehyd(en). Skematisk illustration af synteseproceduren for FeXCo@NC; (b). TEM-billede (indsæt:TEM-billede med høj forstørrelse og Fe-Co NPs størrelsesfordeling); (c) XRD-mønster; (d-e) HAADF-STEM, tilsvare -
 Forskere skaber aktivt materiale ud af mikroskopiske spindende partiklerSelvsamlet dynamisk gitter af spinnere. Voronoi-diagrammet er overlejret med det observerede gitter. Spinnerne er slørede på grund af den lange eksponeringstid, der muliggjorde præcis identifikation a
Forskere skaber aktivt materiale ud af mikroskopiske spindende partiklerSelvsamlet dynamisk gitter af spinnere. Voronoi-diagrammet er overlejret med det observerede gitter. Spinnerne er slørede på grund af den lange eksponeringstid, der muliggjorde præcis identifikation a
- Udtryk af stopbånd i fremadgående volumens spin-bølger
- Udbredt tørring af europæiske tørveområder i de seneste århundreder
- Spektral opløsning af superledende enkeltfotondetektorer mere end fordoblet
- Einstein@Home afslører den sande identitet af den mystiske gammastrålekilde
- Arven fra NASAs daggry, nær slutningen af sin mission
- Undersøgelser finder tilgængelighed af nitrogen til planter faldende, når klimaet varmes op


