Udpegning af biomolekyler med nanometer nøjagtighed
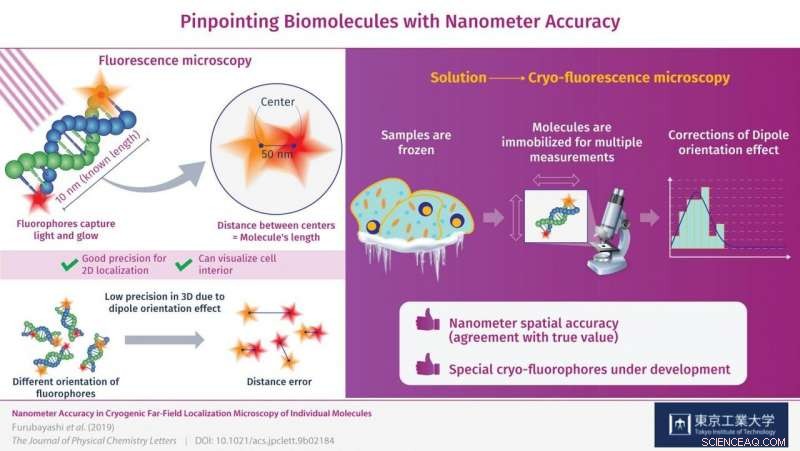
Nanometer nøjagtighed i fjernfelts fluorescenslokaliseringsmikroskopi af to fluoroforer bundet til begge ender af 30 basepar af et dobbeltstrenget DNA (dsDNA) molekyle blev demonstreret ved at bruge kryofluorescensmikroskopi. Kredit:Tokyo Tech
Det ville være umuligt at forstå livet uden at have et fast greb om de mikroskopiske interaktioner mellem molekyler, der opstår i og omkring celler. Mikroskoper er og har været et uvurderligt værktøj for forskere i denne henseende, og der findes mange forskellige typer mikroskoper og mikroskopiteknikker. Derfor, disse forskellige teknikker tjener forskellige formål og har fordele og ulemper.
Især inden for biologi og medicin, forskere søger mikroskopiteknikker for at opnå tredimensionel information om arrangementet og orienteringen af individuelle molekyler i celler på nanometerskalaen. En plausibel tilgang til at opnå dette er kryogen (dvs. ved ekstremt lave temperaturer) elektrontomografi. Imidlertid, denne teknik kan ikke bruges til at observere det indre af celler og er begrænset til tynde skiver ekstraheret fra prøvecellen, hvilket ikke er så nyttigt som at være i stand til direkte at lokalisere molekyler i intakte celler.
For at opnå mere nyttige målinger, synligt lys kan bruges til at belyse specielle prøver i det, der er kendt som fluorescensmikroskopi. Når du bruger denne metode, målmolekylerne er mærket med "fluoroforer, " som er bittesmå molekyler, der absorberer energi fra lys af en specifik farve (frekvens) og derefter genudsender det ved at gløde. Selvom denne tilgang er blevet rapporteret at være nyttig til lokalisering af individuelle fluoroforer i XY-planet (en flad overflade), meningsfuld 3-D lokalisering af biomolekyler kræver mere præcision i Z-retningen, eller dybde, end hvad der er muligt i øjeblikket.
Det er derfor et team af forskere fra Tokyo Tech, herunder Dr. Satoru Fujiyoshi, Nagoya University og Kyoto University dykkede dybt ned i kryofluorescensmikroskopi for at få indsigt i fejlkilderne i sådanne målinger og måder at korrigere dem på. Prøverne, de brugte, var DNA-molekyler af kendt længde (10 nanometer) med forskellige fluoroforer i hver ende.
I første omgang, efter at have taget billeder af begge fluoroforer og bestemt afstanden mellem dem for at se, om den svarede til længden af DNA-molekylerne, der var betydelige fejl i deres målinger. Dette var forårsaget af orienteringen af fluoroforen i 3-D rum, som ikke altid var perfekt på linje med observationsplanet og i stedet var vippet eller skråtstillet. Dette er kendt som "dipolorienteringseffekten" og er en alvorlig begrænsende faktor i fluorescensmikroskopi. Effekten er knyttet til den dårlige målepræcision i Z-retningen og, som forskerne viste, kan rettes.
Det er her, måling ved kryogene forhold kommer i spil. Molekylerne fryses øjeblikkeligt på plads, giver mulighed for højpræcisions 3D-målinger, der modvirker dipolorienteringseffekten. Præcisionen (reproducerbarheden), hvormed fluoroforerne blev lokaliseret, var ±1 nanometer på observationsplanet og ±11 nanometer i Z-retningen, eller dybde, hvilket er uden fortilfælde for denne type mikroskopi. Gennem disse rettelser, forskerne formåede at lokalisere fluoroforerne på DNA-molekylerne med nanometer nøjagtighed (overensstemmelse med sand værdi). "Ved at korrigere dipolorienteringseffekten, vi formåede at forbedre lokaliseringsnøjagtigheden af disse fluoroforer ned til nanometerniveau, " bemærker Dr. Fujiyoshi.
Forskerholdet vil fortsætte deres arbejde med denne tilgang ved hjælp af et par fluoroforer specielt designet til kryogene forhold, hvormed de forventer at opnå endnu bedre resultater. "Denne type kryofluorescensmikroskopi vil bidrage til at afsløre mekanismerne og processerne inde i cellerne på et molekylært niveau, " siger Dr. Fujiyoshi.
Sidste artikelNye fund om genbrugscentre for celler
Næste artikelEn ny måde at pakke flydende dråber på kan forbedre medicinafgivelsen
 Varme artikler
Varme artikler
-
 Trykinduceret 2D-3D konvertering i hybrid blyiodid lagdelt perovskit2D-3D overgang i hybrid perovskites. Kredit:Gang Liu Hydrostatisk tryk kan føre til nye og forbedrede materialeegenskaber. Imidlertid, de fleste nye materialeegenskaber kan kun bevares ved højtryk
Trykinduceret 2D-3D konvertering i hybrid blyiodid lagdelt perovskit2D-3D overgang i hybrid perovskites. Kredit:Gang Liu Hydrostatisk tryk kan føre til nye og forbedrede materialeegenskaber. Imidlertid, de fleste nye materialeegenskaber kan kun bevares ved højtryk -
 Maskinlæring til solenergi er en supercomputer dræberKredit:CC0 Public Domain Supercomputere kunne finde sig selv uden for et job takket være en række nye maskinlæringsmodeller, der producerer hurtige, nøjagtige resultater med en normal bærbar compu
Maskinlæring til solenergi er en supercomputer dræberKredit:CC0 Public Domain Supercomputere kunne finde sig selv uden for et job takket være en række nye maskinlæringsmodeller, der producerer hurtige, nøjagtige resultater med en normal bærbar compu -
 Leviathan polymer børste lavet med E. coli holder bakterier i skakMikroskopisk monster:Et tilfældigt øjeblik i laboratoriet førte til skabelsen af polymerbørster 100 gange den sædvanlige størrelse. Børsterne er synlige under mikroskopet, hvorimod polymerbørster no
Leviathan polymer børste lavet med E. coli holder bakterier i skakMikroskopisk monster:Et tilfældigt øjeblik i laboratoriet førte til skabelsen af polymerbørster 100 gange den sædvanlige størrelse. Børsterne er synlige under mikroskopet, hvorimod polymerbørster no -
 Koralformede nanopartikler bygget af design ved hjælp af konstruerede peptoiderI en ny undersøgelse ledet af PNNL-materialeforsker Chun-Long Chen, sekvensdefinerede peptoider (vist her som kæder af små farverige kugler) muliggjorde den forudsigelige morfologiske udvikling af sfæ
Koralformede nanopartikler bygget af design ved hjælp af konstruerede peptoiderI en ny undersøgelse ledet af PNNL-materialeforsker Chun-Long Chen, sekvensdefinerede peptoider (vist her som kæder af små farverige kugler) muliggjorde den forudsigelige morfologiske udvikling af sfæ
- Xerox administrerende direktør fratræder i forlig med topaktionærer
- Tim Cook ønsker tilbagetrækning af den kinesiske spion-chip-historie, der navngav Apple, Supermikr…
- Atomreaktorer i orkaner:5 spørgsmål besvaret
- NASAs James Webb Space Telescope fuld spejlinstallation en succes
- Undersøgelser viser, at dagens far engagerer sig mere med deres børn
- Nintendo registrerer et ni-måneders overskud, opgraderer den årlige prognose


