Bioinspireret enzymmodel med redox -switch
Kredit:Wiley
Koblede oxygenoverførsler og elektronoverførselsreaktioner, der anvender kofaktorer, er enzymatiske reaktioner af afgørende betydning for alle livsformer fra bakterier til hvirveldyr. I European Journal of Inorganic Chemistry , forskere har introduceret en model for enzymet sulfitoxidase. Det er baseret på et molybdænkompleks, hvis specielle ligander kan oxideres for at muliggøre kobling af oxygenoverførsel til et substrat med en intramolekylær elektronoverførsel. Mellemprodukter indeholdende molybdæn (V) -ion spiller en kritisk rolle.
Mange enzymer fungerer ikke alene; de kræver kofaktorer-ikke-proteinkomponenter, der spiller en rolle i overførslen af elektroner. Disse involverer ofte metalioner, såsom jernet i cytokromer eller sporelementet molybdæn, som findes i molybdænoxotransferaser, enzymer, der overfører iltatomer til substrater. En vigtig repræsentant for sidstnævnte er sulfitoxidase, som oxiderer giftig sulfit til fremstilling af sulfat. Oxygenoverførslen indebærer en ændring af molybdænets oxidationstilstand fra tetravalent (MoIV) til pentavalent (MoV). De involverede elektroner fjernes ved hjælp af cytokromer og bruges til fremstilling af ATP. Pentavalent molybdæn (MoV) synes at være et mellemprodukt i reaktionen.
Forskere, der arbejder med Katja Heinze ved University of Mainz, har nu udviklet en konceptuel tilgang til stabilisering og spektroskopisk karakterisering af de forudsagte mellemprodukter i reaktionerne af Mo-holdige oxotransferaser ved hjælp af modelsystemer. De bruger en metode, der også bruges til at kontrollere katalysatorer:de vedhæfter en molekylær "switch" med en kontrollerbar oxidationstilstand.
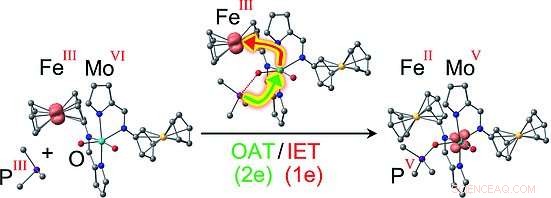
Forskerne valgte at bruge ferrocen/ferrocenium redox -par, hvor et jernatom er klemt mellem to negativt ladede, aromatisk, femledede carbonringe. Ironionen kan skifte mellem en tilstand med en dobbelt positiv ladning (FeII, ferrocen) og en tredobbelt positivt ladet, oxideret tilstand (FeIII, ferrocenium). Dette er analogt med de naturligt forekommende cytokrome kofaktorer, som også kan indeholde FeII eller FeIII. Forskerne knyttet to af disse ferrocen/ferrocenium "switches" til et molybdænkompleks som en model for det aktive centrum af en sulfitoxidase. Molybdæn er i VI -oxidationstilstand og har to iltatomer knyttet til dobbeltbindinger. Reaktion med et organisk phosphan (et fosfor-carbonhydridmolekyle) som et ilt-acceptorsubstratmodel forekommer med variable hastigheder, afhængigt af afgifterne på "switches", fordi redoxstatus for ferrocenylsubstituenter modulerer energibarrierer for visse mellemprodukter. Dette resulterer i en række addukter mellem Mo -komplekset og phosphanen.
De mest interessante versioner er dem med to FeIII -ioner eller en FeII- og en FeIII -ion:I disse tilfælde, mekanismen er ikke længere en simpel overførsel af et oxygenatom til substratet, hvad angår FeII/ FeII -versionen. I stedet er den koblet til en intramolekylær elektronoverførsel, muligvis konceptuelt ligner den for naturlige sulfitoxidaser. Under oxygenoverførselsreaktionen, en elektron overføres fra molybdæn til en af FeIII -ionerne, hvilket resulterer i en ladningsfordeling på enten FeII FeIII MoV eller FeII FeII MoV. For sidstnævnte version, forskerne var i stand til at bruge elektron -spin -resonansspektroskopi til entydigt at opdage MoV -mellemproduktet FeII FeII MoV med det oxiderede substrat (produktet) stadig bundet til det. Koblingen af oxygenoverførslen til en intermolekylær elektronoverførsel sænker aktiveringsbarrieren for dette reaktionstrin og stabiliserer samtidig MoV -mellemproduktet, som forudsagt af computermodellerne.
Forskerne foreslår at bruge dette nye system som en model for oxygenatomoverførsel og intramolekylære elektronoverførselstrin i sulfitoxidaser, og håber at bruge dette nye koncept til at udvikle analoger til yderligere enzymatiske reaktioner med koblet elektronoverførsel. I fremtiden, det synes også muligt at udvide dette koncept til omskiftelige katalytiske reaktioner, der ikke har nogen naturlig prototype.
 Varme artikler
Varme artikler
-
 Søger efter livets kemiNucleobase pulver og stålkugler i en fræsebeholder. Kredit:Rudjer Boskovic Instituttet, Tomislav Stolar I søgen efter livets kemiske oprindelse, forskere har fundet en mulig alternativ vej til fre
Søger efter livets kemiNucleobase pulver og stålkugler i en fræsebeholder. Kredit:Rudjer Boskovic Instituttet, Tomislav Stolar I søgen efter livets kemiske oprindelse, forskere har fundet en mulig alternativ vej til fre -
 Industriaffald genbruges til at producere alternativer til plastForskere ved São Paulo State University genbrugte bakteriecelluloseaffald, der normalt blev smidt af producenter af sårforbindinger for at lave stærk bionedbrydelig film til mademballage (rester tilba
Industriaffald genbruges til at producere alternativer til plastForskere ved São Paulo State University genbrugte bakteriecelluloseaffald, der normalt blev smidt af producenter af sårforbindinger for at lave stærk bionedbrydelig film til mademballage (rester tilba -
 Blistervæske kan hjælpe med at diagnosticere forbrændingens sværhedsgradKredit:American Chemical Society Alvorlige forbrændinger kan efterlade fysiske og psykiske ar, især hos børn. Når en forbrændingspatient kommer ind på klinikken, læger bruger faktorer som forbrænd
Blistervæske kan hjælpe med at diagnosticere forbrændingens sværhedsgradKredit:American Chemical Society Alvorlige forbrændinger kan efterlade fysiske og psykiske ar, især hos børn. Når en forbrændingspatient kommer ind på klinikken, læger bruger faktorer som forbrænd -
 Forskere skaber formhukommelses-aerogeler med gummilignende elasticitetTime-lapse af en aerogel, der bøjer tilbage til sin oprindelige form. Kredit:Sam OKeefe, Missouri S&T Polymere aerogeler er nanoporøse strukturer, der kombinerer nogle af de mest ønskværdige egens
Forskere skaber formhukommelses-aerogeler med gummilignende elasticitetTime-lapse af en aerogel, der bøjer tilbage til sin oprindelige form. Kredit:Sam OKeefe, Missouri S&T Polymere aerogeler er nanoporøse strukturer, der kombinerer nogle af de mest ønskværdige egens
- NASA finder kraftigt regnpotentiale i tropisk storm Hikaa
- Studier af fjerne galakser udfordrer forståelsen af, hvordan stjerner dannes
- Metoder til bortskaffelse af husholdningsaffald
- Grafen viser et unikt potentiale til at overgå båndbreddekravene til fremtidig telekommunikation
- Hjerneløs,
- Hvordan brande ændrer tundraens ansigt


