Kemikere opdager uventet enzymstruktur
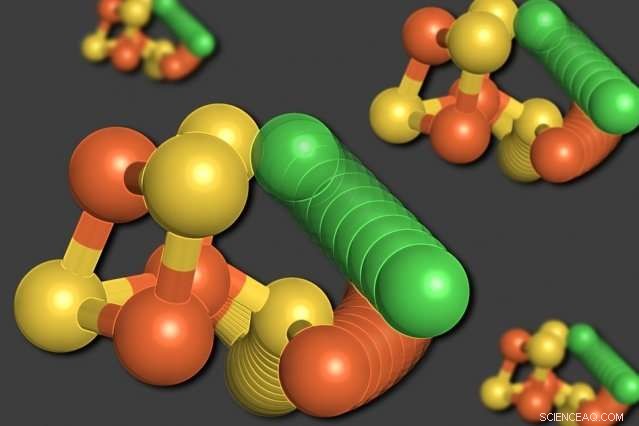
MIT-forskere har vist, at nogle af atomerne i et enzym kaldet carbonmonoxiddehydrogenase kan omarrangere sig selv, når iltniveauet er lavt. Et nikkelatom (grønt) forlader den terninglignende struktur, fortrænge et jernatom (orange). Et svovlatom (gult) bevæger sig også ud af kuben. Kredit:Elizabeth Wittenborn
Mange mikrober har et enzym, der kan omdanne kuldioxid til kulilte. Denne reaktion er afgørende for at opbygge kulstofforbindelser og generere energi, især for bakterier, der lever i iltfrie omgivelser.
Dette enzym er også af stor interesse for forskere, der ønsker at finde nye måder at fjerne drivhusgasser fra atmosfæren og omdanne dem til nyttige kulstofholdige forbindelser. Nuværende industrielle metoder til omdannelse af kuldioxid er meget energikrævende.
"Der er industrielle processer, der udfører disse reaktioner ved høje temperaturer og høje tryk, og så er der dette enzym, der kan gøre det samme ved stuetemperatur, " siger Catherine Drennan, en MIT-professor i kemi og biologi og en Howard Hughes Medical Institute Investigator. "I lang tid, folk har været interesseret i at forstå, hvordan naturen udfører denne udfordrende kemi med denne samling af metaller."
Drennan og hendes kolleger ved MIT, Brandeis Universitet, og Aix-Marseille Universitet i Frankrig har nu opdaget et unikt aspekt af strukturen af "C-klyngen" - samlingen af metal- og svovlatomer, der danner hjertet af enzymet carbonmonoxiddehydrogenase (CODH). I stedet for at danne et stift stillads, som forventet, klyngen kan faktisk ændre sin konfiguration.
"Det var ikke, hvad vi forventede at se, " siger Elizabeth Wittenborn, en nylig MIT Ph.D. modtager og hovedforfatter af undersøgelsen, som optræder i bladets nummer 2. oktober eLife .
Et molekylært vognhjul
Metalholdige klynger som C-klyngen udfører mange andre kritiske reaktioner i mikrober, herunder spaltning af nitrogengas, som er svære at kopiere industrielt.
Drennan begyndte at studere strukturen af carbonmonoxiddehydrogenase og C-klyngen for omkring 20 år siden, kort efter hun startede sit laboratorium på MIT. Hun og en anden forskergruppe kom hver især med en struktur for enzymet ved hjælp af røntgenkrystallografi, men strukturerne var ikke helt de samme. Forskellene blev til sidst løst, og strukturen af CODH blev anset for at være veletableret.
Wittenborn startede projektet for nogle år siden, i håb om at finde ud af, hvorfor enzymet er så følsomt over for inaktivering af ilt og bestemme, hvordan C-klyngen bliver sat sammen.
Til forskernes overraskelse, deres analyse afslørede to forskellige strukturer for C-klyngen. Den første var et arrangement, de havde forventet at se - en terning bestående af fire svovlatomer, tre jernatomer, og et nikkelatom, med et fjerde jernatom forbundet med terningen.
I den anden struktur, imidlertid, nikkelatomet fjernes fra den terninglignende struktur og træder i stedet for det fjerde jernatom. Det fortrængte jernatom binder sig til en nærliggende aminosyre, cystein, som holder den på sin nye placering. Et af svovlatomerne bevæger sig også ud af kuben. Alle disse bevægelser ser ud til at forekomme i forening, i en bevægelse, forskerne beskriver som et "molekylært vognhjul".
"Svovlen, jernet, og nikkel flytter alle til nye steder, Drennan siger. "Vi var virkelig chokerede. Vi troede, vi forstod dette enzym, men vi fandt ud af, at det gør denne utroligt dramatiske bevægelse, som vi aldrig havde forventet. Så kom vi med flere beviser for, at dette faktisk er noget, der er relevant og vigtigt - det er ikke bare et lykketræf, men en del af designet af denne klynge."
Forskerne mener, at denne bevægelse, som opstår ved ilteksponering, hjælper med at beskytte klyngen mod fuldstændigt og irreversibelt at falde fra hinanden som reaktion på ilt.
"Det ser ud til, at dette er et sikkerhedsnet, tillader metallerne at blive flyttet til steder, hvor de er mere sikre på proteinet, " siger Drennan.
Douglas Rees, professor i kemi ved Caltech, beskrev papiret som "en smuk undersøgelse af en fascinerende klyngekonverteringsproces."
"Disse klynger har minerallignende træk, og det kunne tænkes, at de ville være 'så stabile som en sten,' " siger Rees, som ikke var involveret i undersøgelsen. "I stedet, klyngerne kan være dynamiske, som giver dem egenskaber, der er afgørende for deres funktion i biologiske omgivelser."
Ikke et stift stillads
Dette er det største metalskift, der nogensinde er set i nogen enzymklynge, men mindre omarrangeringer er set i nogle andre, inklusive en metalklynge fundet i enzymet nitrogenase, som omdanner nitrogengas til ammoniak.
"I fortiden, folk tænkte på disse klynger som virkelig disse stive stilladser, men lige inden for de sidste par år er der kommet flere og flere beviser på, at de ikke er rigtig stive, " siger Drennan.
Forskerne forsøger nu at finde ud af, hvordan celler samler disse klynger. Lær mere om, hvordan disse klynger fungerer, hvordan de er samlet, og hvordan de påvirkes af ilt kunne hjælpe forskere, der forsøger at kopiere deres handling til industriel brug, Drennan siger. Der er stor interesse for at finde på måder at bekæmpe ophobning af drivhusgasser ved at for eksempel, omdannelse af kuldioxid til kulilte og derefter til acetat, som kan bruges som byggesten til mange slags nyttige kulstofholdige forbindelser.
"Det er mere kompliceret, end folk troede. Hvis vi forstår det, så har vi en meget bedre chance for virkelig at efterligne det biologiske system, " siger Drennan.
Denne historie er genudgivet med tilladelse fra MIT News (web.mit.edu/newsoffice/), et populært websted, der dækker nyheder om MIT-forskning, innovation og undervisning.
 Varme artikler
Varme artikler
-
 En let vej til polymerbelægninger med potentiel anvendelse i forebyggelse af biofoulingNy polymerisationsmetode åbner døren til mere effektive belægninger mod begroning. Kredit:A*STAR Institute of Chemical and Engineering Sciences En enkel metode til dyrkning af giftfri antifouling
En let vej til polymerbelægninger med potentiel anvendelse i forebyggelse af biofoulingNy polymerisationsmetode åbner døren til mere effektive belægninger mod begroning. Kredit:A*STAR Institute of Chemical and Engineering Sciences En enkel metode til dyrkning af giftfri antifouling -
 Opdager nye leads til funktionelle materialer styret af kunstig intelligensKredit:Wiley Søger efter blymaterialer med specifikke egenskaber, forskere har udviklet en arbejdsgang, der inkorporerer kunstig intelligens til at guide opdagelsen af en ny keramisk struktur me
Opdager nye leads til funktionelle materialer styret af kunstig intelligensKredit:Wiley Søger efter blymaterialer med specifikke egenskaber, forskere har udviklet en arbejdsgang, der inkorporerer kunstig intelligens til at guide opdagelsen af en ny keramisk struktur me -
 Forskere tager røntgenmål for at opdage ny brændstofkatalysatorDenne grafik viser de hybridorbitaler, hvor atomer kan dele elektroner i koboltboratkatalysatorer, hvilket gør det til en bedre vandspaltende katalysator end koboltphosphat. Kredit:Argonne National La
Forskere tager røntgenmål for at opdage ny brændstofkatalysatorDenne grafik viser de hybridorbitaler, hvor atomer kan dele elektroner i koboltboratkatalysatorer, hvilket gør det til en bedre vandspaltende katalysator end koboltphosphat. Kredit:Argonne National La -
 Ny effektiv, lavtemperatur katalysator til brintproduktionBrookhaven Labs kemikere Ping Liu og José Rodriguez var med til at karakterisere strukturelle og mekanistiske detaljer om en ny lavtemperatur-katalysator til fremstilling af høj renhedsgrad af hydroge
Ny effektiv, lavtemperatur katalysator til brintproduktionBrookhaven Labs kemikere Ping Liu og José Rodriguez var med til at karakterisere strukturelle og mekanistiske detaljer om en ny lavtemperatur-katalysator til fremstilling af høj renhedsgrad af hydroge


