Molekyleundersøgelser afslører potentiel behandling for patienter med slagtilfælde
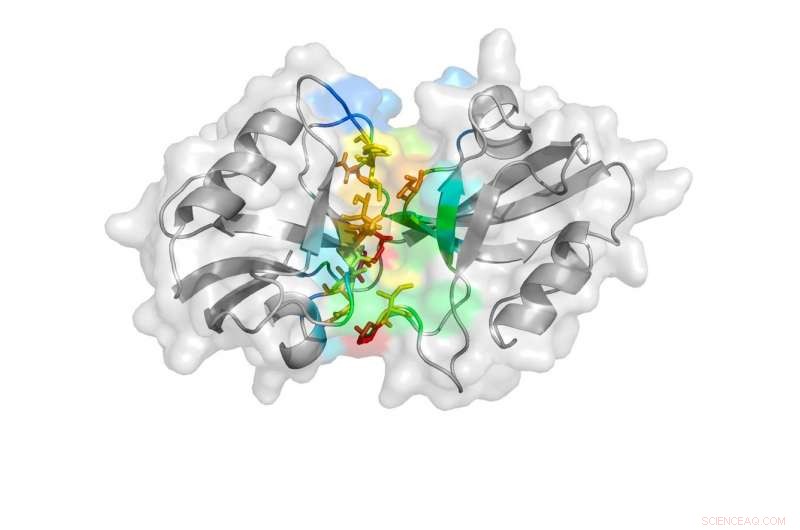
En tegneserierepræsentation afsløret af undersøgelsen viser den lukkede tilstand af PDZ-domænerne. Kredit: Naturkommunikation , doi:10.1038/s41467-018-06133-0
I en forlængelse af forskning offentliggjort for en måned siden i Naturens metoder , en ny hybrid tilgang udført af forskere fra Clemson Universitys afdeling for fysik og astronomi og Stony Brook University har afsløret en 3-D struktur af et proteinfragment, der kunne tjene som et lægemiddelmål ved behandling af patienter med slagtilfælde.
Proteinet kaldet "postsynaptisk densitetsprotein på 95 kDa (PSD-95)" er placeret på neuroner i hjernen, der modtager kemiske beskeder - neurotransmittere - fra tilstødende neuroner. Ved at rekruttere receptorer og andre hjælpeproteiner, PSD-95 arbejder for at opretholde integriteten af neurale forbindelser over tid, derved letter neural kommunikation, indlæring og hukommelse.
PSD-95 består af fem dele, eller domæner, at hver spiller en forskellig rolle i proteinets overordnede funktion. To af disse domæner, kaldet PDZ-1 og PDZ-2, har vist sig at påvirke symptomer forbundet med iskæmisk slagtilfælde, såsom lammelse eller talebesvær.
"En af de ideer, der er blevet postuleret i litteraturen, er at skabe et multivalent lægemiddel, der retter sig mod begge PDZ-domæner, fordi de er meget ens i naturen. Hvis du kan blokere PDZ-domænerne fra at binde bestemte proteiner eller enzymer, du kan reducere de invaliderende virkninger af et slagtilfælde, " sagde Hugo Sanabria, hovedforfatter på undersøgelsen.
Udfordringen, imidlertid, er, at det er næsten umuligt at designe en lægemiddelhæmmer uden først at kende den nøjagtige struktur af PDZ-domænerne af PSD-95. Det ville være som at køre på tværs af landet uden at have et kort over USA.
"Biomolekylers biologiske funktioner er bestemt af deres strukturer, så vi har brug for detaljerede strukturelle og dynamiske indsigter i PDZ-1 og -2 for at hjælpe med bedre at forstå deres funktionelle roller og hjælpe i designet af nye inhibitorer, " sagde Feng Ding, Sanabrias kollega her hos Clemson.
Der findes en håndfuld tilgange til at gengive strukturen af biomolekyler. Men i tilfælde af PSD-95, hver tilgang - NMR-spektroskopi, Røntgenkrystallografi og Förster resonansenergioverførsel (FRET) - leverede en anden strukturel model. Forskernes samarbejdspartner ved Stony Brook University, lektor Mark Bowen i afdelingen for fysiologi og biofysik, etablerede et partnerskab med Sanabria om dette projekt, efter at han afslørede en af de inkonsekvente strukturelle modeller af PSD-95-fragmentet.
Sanabrias laboratorium adresserede denne uoverensstemmelse ved først at modellere PSD-95-fragmentet ved hjælp af FRET, en tilgang, der identificerer mulige konfigurationer af biomolekyler. Under denne metode, Sanabria vedhæftede to lysfølsomme molekyler, kaldet kromoforer, i to forskellige positioner på PSD-95-fragmentet. Han afdækkede derefter afstanden mellem kromoforerne ved at visualisere fragmentet under et mikroskop. Dette blev gentaget flere gange fra forskellige fastgørelsespunkter.
"For modelleringsaspektet, FRET giver dig afstande mellem kromoforer, men det er ikke nok til at udfylde alle de geometriske begrænsninger af molekylet, så vi er nødt til at stole på noget andet, en anden metode. Det er her professor Ding kommer ind i billedet, " sagde Sanabria.
Ding leder et datateknisk biofysiklaboratorium på Clemson University, hvor han bruger computersoftware til at måle, hvordan biomolekyler ser ud, bevæge sig og fungere. Hans tilgang til modellering bruger en computersimulering kendt som diskret molekylær dynamik (DMD), der kortlægger landskabet af et biomolekyle, forudsige proteiners baner, når de folder og interagerer med andre molekyler. Den efterfølgende simulering kan afspilles som en film, hjælper forskere med at visualisere proteinadfærd over tid.
"Hvis du laver traditionelle molekylære simuleringer, typisk vil du prøve en meget lille del af rummet, især for større molekyler, så du kommer ikke til at have et godt overblik over, hvordan hele molekylet vil se ud selv under fysiologiske forhold, "Sanabria sagde. "Diskret molekylær dynamik er en meget hurtigere og mindre beregningsmæssigt dyr måde at nøjagtigt og hurtigt prøve det konformationelle rum af proteiner."
At gøre det, Sanabria opnåede først et sæt afstande ved at måle PSD-95 med FRET. I det forsøg, Sanabria havde 10 prøver af PSD-95-fragmentet, som hver gengav forskellige afstande, og tre almindelige former - eller konformationer - af PSD-95 blev observeret. Endnu, uden en DMD-simulering, der var ingen måde for forskerne at vide, hvilken afstand der svarede til hvilken konformation af fragmentet. Så de indtaster hver mulig afstand mod hver mulig form og lader simuleringen gøre resten.
"Når vi lavede den første simulering, vi så, at der var tre hovedtilstande, som PDZ-1 og -2 tog. Den ene viste meget tæt kontakt mellem de to, en viste et sæt mellemkontakt, og en havde ingen kontakt overhovedet, " sagde Ding.
Forskerne kørte derefter en DMD-simulering igen uden at overveje FRET-afstandene for at bekræfte, at de tre observerede tilstande eksisterer i naturen og ikke blot er et lykketræf pålagt af FRET-afstandene. De undersøgte strukturerne yderligere ved at se på, hvordan individuelle aminosyrer, som udgør PDZ-domænerne, binde sig til hinanden. Ud fra disse analyser, Ding, Bowen og Sanabria var i stand til at bekræfte, at PDZ-domænerne antager to ud af de tre observerede tilstande i DMD-simuleringen - det med en vis kontakt og det uden nogen som helst kontakt.
"Nu, vi har to potentielle mål for udvikling af nye lægemidler, der vil være mere effektive end dem, der er tilgængelige i øjeblikket, " sagde Sanabria. "Udsigterne for slagtilfældepatienter er lovende."
Uden diskret molekylær dynamik, som kan fange konformationsændringer, der opstår på mikrosekunders tidsskala, disse to stater ville være blevet savnet, som de var i tidligere undersøgelser.
"De fleste af de mennesker, der laver FRET-styret strukturel modellering, arbejder med et stift molekyle, ligesom DNA. Hvis du har et stift molekyle, det er nemt at modellere – du har kun en enkelt tilstand at fange. Du kan tildele FRET-afstandene, og der er virkelig ikke noget problem, " sagde Sanabria. "I dette tilfælde, vi overgik denne tilgang på mange måder."
I fremtidige undersøgelser, holdet søger at analysere potentialet for, at PSD-95-fragmentet auto-hæmmer sig selv baseret på fragmentets egen struktur.
 Varme artikler
Varme artikler
-
 Kemisk sensor på basis af materialer, der besidder molekylær hukommelseEn kemisk sensor på basis af materialer, der besidder molekylær hukommelse. Kredit:Vita Nikitina Forskere fra det kemiske fakultet ved Lomonosov Moscow State University har udviklet en polymerbase
Kemisk sensor på basis af materialer, der besidder molekylær hukommelseEn kemisk sensor på basis af materialer, der besidder molekylær hukommelse. Kredit:Vita Nikitina Forskere fra det kemiske fakultet ved Lomonosov Moscow State University har udviklet en polymerbase -
 Bakterier gør blå jeans grønneBio-indican kan bruges som en effektiv, reduktionsmiddelfri bomuldstekstilfarve. (a) Øverste række, Ren indican uden β-glucosidase (BGL); ren indican med β-glucosidase; bio-indican med β-glucosidase.
Bakterier gør blå jeans grønneBio-indican kan bruges som en effektiv, reduktionsmiddelfri bomuldstekstilfarve. (a) Øverste række, Ren indican uden β-glucosidase (BGL); ren indican med β-glucosidase; bio-indican med β-glucosidase. -
 En ny måde at syntetisere antioxidante stoffer påKredit:Tomsk Polytechnic University (TPU) Forskere fra Tomsk Polytechnic University har sammen med deres kolleger fra USA og Japan foreslået en ny måde at løse den vigtigste og grundlæggende udfor
En ny måde at syntetisere antioxidante stoffer påKredit:Tomsk Polytechnic University (TPU) Forskere fra Tomsk Polytechnic University har sammen med deres kolleger fra USA og Japan foreslået en ny måde at løse den vigtigste og grundlæggende udfor -
 Sådan smeltes plastflasker til formningDe fleste af os smider blot tomme plastflasker væk uden en anden tanke. At lære at smelte dem med en brødristerovn og forme dem er imidlertid en billig hobby, der giver dig mulighed for at udforske di
Sådan smeltes plastflasker til formningDe fleste af os smider blot tomme plastflasker væk uden en anden tanke. At lære at smelte dem med en brødristerovn og forme dem er imidlertid en billig hobby, der giver dig mulighed for at udforske di
- Forskere modellerer molekylær bevægelse inden for snævre kanaler af mesoporøse nanopartikler
- Ny skærmbelægning gør læsning i sollys meget nemmere – hemmeligheden? Møl øjne
- Dyr, der lever i baldakin af regnskoven
- FAA-chef møder Boeing embedsmænd, prøver Max simulator
- Det virtuelle laboratorium
- Fysikere opdager et nyt kvantetrick til grafen:magnetisme


