Forskere simulerer det intracellulære miljø i en selvlysende bakteriecelle
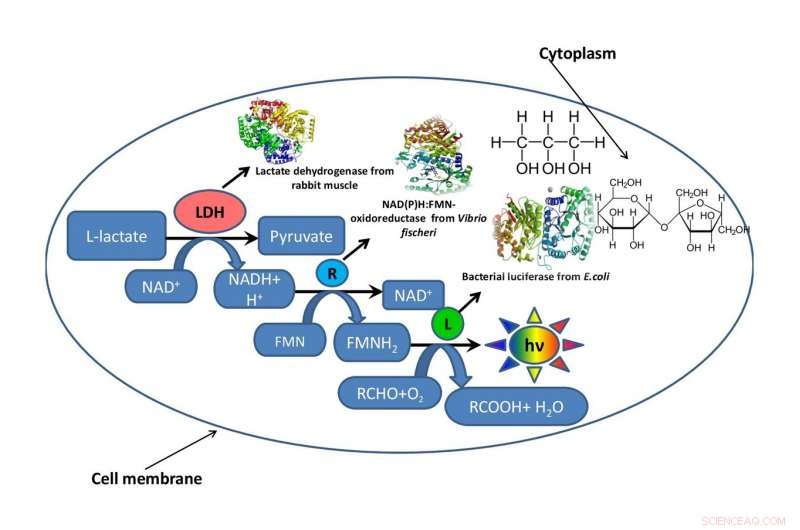
Et skema af en bakteriecelle med et fragment af en metabolisk kæde, der fungerer inde i den, omgivet af glycerol eller saccharose, der efterligner det intracellulære miljø. Kredit:Oleg Sutormin.
Et hold fra Institute of Fundamental Biology and Biotechnology of SFU brugte glycerol og saccharose til at simulere det intracellulære miljø af selvlysende bakterier og udførte en række enzymatiske reaktioner. De håber at udvikle fragmenter af metaboliske kæder med forskellige længder og studere fermentative reaktioner under forhold tæt på intracellulære. Forskningen blev offentliggjort i Molekylær katalyse tidsskrift.
Hundredvis af reaktioner, der involverer enzymer, forekommer konstant i celler. For at studere dem mere detaljeret, forskere forsøger at skabe omfattende eksperimentelle modeller af det intracellulære miljø. Et interessant træk ved sådanne kunstige miljømodeller er muligheden for at justere deres parametre for at forstå, hvordan en bestemt enzymatisk reaktion ville reagere og forskellene mellem enzymreaktioner i en celle og dem under rørbetingelser.
For at forstå, hvordan viskositeten af reaktionsblandingen påvirker hastigheden af enzymatiske processer, et hold fra Institute of Fundamental Biology and Biotechnology of SFU simulerede det intracellulære miljø ved hjælp af to organiske opløsningsmidler - glycerol og saccharose. For at teste effekten af reaktionsblandingens viskositet, forskerne brugte et fragment af en bioluminescerende metabolisk kæde.
Arbejdet bestod af tre faser. På den første etape, biofysikerne udviklede flere kunstige modelsystemer lavet af glycerol og saccharose med forskellige koncentrationer af komponenter, men de samme viskositetsniveauer for reaktionsmediet. På anden etape, de bestemte, hvordan viskositeten af reaktionsblandingen påvirkede hastigheden af en enzymatisk reaktion i det koblede system af tre enzymer:LDH, NAD (P) H:FMN-oxidoreduktase, og luciferase. På tredje etape, forskerne evaluerede den termiske stabilitet af triple-enzymsystemet ved temperaturintervallet fra 15 til 80 grader.
Som et resultat af undersøgelsen, forskerne konkluderede, at saccharose begrænsede enzymernes mobilitet mere effektivt end glycerol. Mobilitetsbegrænsning kan føre til ændringer i reaktionshastigheden eller endda mekanisme. Forskerne anbefaler yderligere undersøgelse af den stigende termiske stabilitet af enzymer i viskøse reaktionsblandingsmiljøer og stigende temperatur. De foreslår også en tilgang til at konstruere de cellulære multi-enzym metaboliske kæder inde i den lysende bakteriecelle.
"På grund af det enorme antal enzymreaktioner inde i en rigtig celle, for at metabolismeprocessen kan fortsætte hurtigt og kontinuerligt i den, enzymer bør have høj kooperativitet. Derfor, jo mere ændring i den termiske stabilitet af enzymer i nærvær af viskogener, jo bedre samarbejde mellem undersøgte enzymsystemer inde i de virkelige celleforhold, og jo større er muligheden for, at et kunstigt fragment af en metabolisk kæde ville være naturligt for en bakteriecelle. Det er ekstremt vigtigt at studere indflydelsen af tyktflydende organiske opløsningsmidler på hastigheden og den termiske stabilitet af enzymatiske reaktioner. Det unikke ved vores undersøgelse er, at vi bruger naturlige forbindelser - glycerol og saccharose, som faktisk findes i den rigtige celle, i modsætning til crowding-midler, der bruges i lignende undersøgelser af andre forskere, " siger Oleg Sutormin, en medforfatter til undersøgelsen, og juniorforsker ved Laboratory of Bioluminescent Biotechnologies of SFU.
 Varme artikler
Varme artikler
-
 Datavidenskab hjælper ingeniører med at opdage nye materialer til solceller og LED'erSkematisk illustration af arbejdsgangen for high-throughput design af organisk-uorganisk hybrid halogenid-halvledere til solceller og lysdioder. Kredit:Yang lab/Energy &Environmental Science Ingen
Datavidenskab hjælper ingeniører med at opdage nye materialer til solceller og LED'erSkematisk illustration af arbejdsgangen for high-throughput design af organisk-uorganisk hybrid halogenid-halvledere til solceller og lysdioder. Kredit:Yang lab/Energy &Environmental Science Ingen -
 Forskning giver nyt håb for solbrændstofKredit:CC0 Public Domain Et team af eksperter i vedvarende energi fra University of Exeter har været banebrydende for en ny teknik til at producere brint fra sollys for at skabe en ren, billigt og
Forskning giver nyt håb for solbrændstofKredit:CC0 Public Domain Et team af eksperter i vedvarende energi fra University of Exeter har været banebrydende for en ny teknik til at producere brint fra sollys for at skabe en ren, billigt og -
 Forklaring af, hvorfor kondens er eksotermEn eksoterm reaktion afgiver varmeenergi. Kondensation er den proces, hvor vanddamp omdannes til flydende vand. Dette forekommer typisk, når vanddampmolekyler kommer i kontakt med køligere molekyle
Forklaring af, hvorfor kondens er eksotermEn eksoterm reaktion afgiver varmeenergi. Kondensation er den proces, hvor vanddamp omdannes til flydende vand. Dette forekommer typisk, når vanddampmolekyler kommer i kontakt med køligere molekyle -
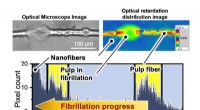 Bestemmelse af slankning af træmasseFigur 1. Pixelopløst distributionsanalyse viser, at den optiske retardering falder med stigende grad af papirmasseflimmer. Kredit:Osaka University Forskere fra Institute of Scientific and Industri
Bestemmelse af slankning af træmasseFigur 1. Pixelopløst distributionsanalyse viser, at den optiske retardering falder med stigende grad af papirmasseflimmer. Kredit:Osaka University Forskere fra Institute of Scientific and Industri
- Ja,
- Afstemning:Teenagere siger, at sociale medier får dem til at føle sig bedre
- En skovbrand rammer en kvart million hektar brændt
- Alternativ til traditionelle batterier rykker et skridt tættere på virkeligheden efter spændende …
- Uber sigter efter en børsdebutværdi på op til 90 mia. USD:rapport
- Ny billedbehandlingsteknik hjælper med at løse nanodomæner, kemisk sammensætning i cellemembrane…


