Ny billedbehandlingsteknik hjælper med at løse nanodomæner, kemisk sammensætning i cellemembraner
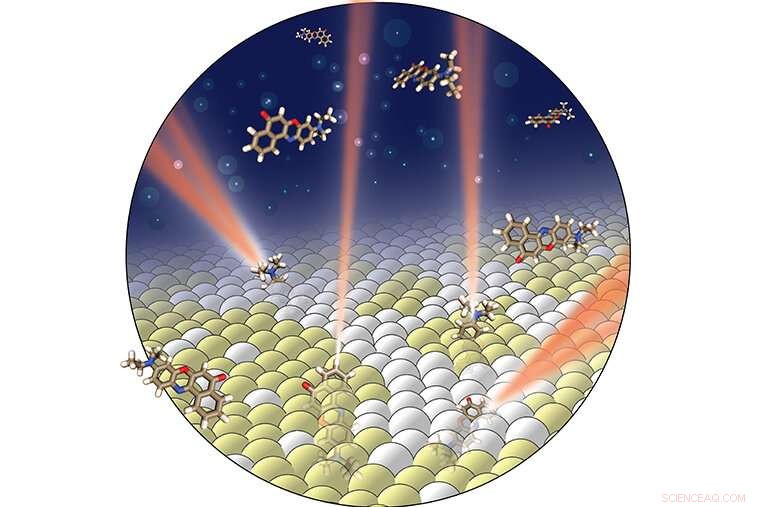
Brug af egenskaber af lys fra fluorescerende prober er kernen i en ny billedbehandlingsteknik, der giver mulighed for et hidtil uset kig inde i cellemembraner. Kredit:Jin Lu
For dem, der ikke er involveret i kemi eller biologi, at forestille sig en celle leder sandsynligvis tankerne hen på flere diskrete, klatformede genstande; måske kernen, mitokondrier, ribosomer og lignende.
Der er én del, der ofte bliver overset, gem måske en snoet streg, der angiver cellens grænse:membranen. Men dens rolle som gatekeeper er en væsentlig rolle, og en ny billedbehandlingsteknik udviklet på McKelvey School of Engineering ved Washington University i St. Louis giver en måde at se ind i, i modsætning til gennem, denne gennemsigtige, fed, beskyttende kappe.
Den nye teknik, udviklet i Matthew Lews laboratorium, assisterende professor i Preston M. Green Department of Electrical and Systems Engineering, giver forskere mulighed for at skelne samlinger af lipidmolekyler af samme fase - samlingerne kaldes nanodomæner - og bestemme den kemiske sammensætning inden for disse domæner.
Detaljerne i denne teknik - enkelt-molekyle orienteringslokaliseringsmikroskopi, eller SMOLM – blev offentliggjort online 21. august in Angewandte Chemie , tidsskriftet for det tyske kemiselskab.
Redaktører på tidsskriftet - en førende inden for generel kemi - valgte Lew's papir som et "Hot Paper" om emnet nanoskala artikler. Hot Papers udmærker sig ved deres betydning i et hurtigt udviklende felt af stor interesse.
Brug af traditionelle billedteknologier, det er svært at sige, hvad der er "inde i" versus "udenfor" en squishy, gennemsigtig genstand som en cellemembran, Lew sagde, især uden at ødelægge det.
"Vi ønskede en måde at se ind i membranen uden traditionelle metoder" - såsom at indsætte et fluorescerende sporstof og se det bevæge sig gennem membranen eller bruge massespektrometri - "hvilket ville ødelægge det, " sagde Lew.
At sondere membranen uden at ødelægge den, Jin Lu, en postdoktor i Lews laboratorium, også anvendt en fluorescerende probe. I stedet for at skulle spore en vej gennem membranen, imidlertid, denne nye teknik bruger lyset, der udsendes af en fluorescerende probe, til direkte at "se", hvor proben er, og hvor den "spidser" i membranen. Sondens orientering afslører information om både membranens fase og dens kemiske sammensætning.
"I cellemembraner, der er mange forskellige lipidmolekyler, " sagde Lu. "Nogle danner væske, nogle danner en mere fast eller gelfase."
Molekyler i en fast fase er stive og deres bevægelse begrænset. De er, med andre ord, bestilt. Når de er i flydende fase, imidlertid, de har mere frihed til at rotere; de er i en uordnet fase.
Brug af en model lipid-dobbeltlag til at efterligne en cellemembran, Lu tilføjede en opløsning af fluorescerende prober, såsom Nile rød, og brugte et mikroskop til at se proberne kort fastgøres til membranen.
En sondes bevægelse, mens den er fastgjort til membranen, bestemmes af dens miljø. Hvis omgivende molekyler er i en uordnet fase, sonden har plads til at vrikke. Hvis de omgivende molekyler er i en ordnet fase, sonden, ligesom de nærliggende molekyler, er fast.

Kredit:Washington University i St. Louis
Når lyset skinner på systemet, sonden frigiver fotoner. En billeddannelsesmetode, der tidligere er udviklet i Lew-laboratoriet, analyserer derefter dette lys for at bestemme orienteringen af molekylet, og om det er fikseret eller roterende.
"Vores billedbehandlingssystem fanger det udsendte lys fra enkelte fluorescerende molekyler og bøjer lyset for at producere specielle mønstre på kameraet, " sagde Lu.
"Baseret på billedet, vi kender sondens orientering, og vi ved, om den er roterende eller fast, " og derfor, om det er indlejret i et bestilt nanodomæne eller ej.
At gentage denne proces hundredtusindvis af gange giver nok information til at bygge et detaljeret kort, viser de ordnede nanodomæner omgivet af havet af de uordnede flydende områder af membranen.
Den anvendte fluorescerende sonde Lu, Nilen rød, er også i stand til at skelne mellem lipidderivater inden for de samme nanodomæner. I denne sammenhæng, deres valgte fluorescerende probe kan fortælle, om lipidmolekylerne er hydrolyseret, når et bestemt enzym var til stede.
"Dette lipid, kaldet sphingomyelin, er en af de kritiske komponenter involveret i nanodomænedannelse i cellemembranen. Et enzym kan omdanne et sphingomyelin-molekyle til ceramid, " sagde Lu. "Vi mener, at denne omdannelse ændrer måden, hvorpå probemolekylet roterer i membranen. Vores billedbehandlingsmetode kan skelne mellem de to, selvom de bliver i det samme nanodomæne."
Denne beslutning, et enkelt molekyle i model lipid dobbeltlag, kan ikke opnås med konventionelle billedbehandlingsteknikker.
Denne nye SMOLM-teknik kan løse interaktioner mellem forskellige lipidmolekyler, enzymer og fluorescerende prober med detaljer, der aldrig er blevet opnået tidligere. Dette er vigtigt, især inden for kemi af blødt stof.
"På denne skala, hvor molekyler konstant bevæger sig, alt er selvorganiseret, " sagde Lew. Det er ikke som solid-state elektronik, hvor hver komponent er forbundet på en specifik og vigtigst statisk måde.
"Hvert molekyle føler kræfter fra dem, der omgiver det; det er det, der bestemmer, hvordan et bestemt molekyle vil bevæge sig og udføre sine funktioner."
Individuelle molekyler kan organisere sig i disse nanodomæner, samlet, kan hæmme eller opmuntre visse ting - som at lade noget komme ind i en celle eller holde det udenfor.
"Dette er processer, som er notorisk svære at observere direkte, " sagde Lew. "Nu, alt hvad du behøver er et fluorescerende molekyle. Fordi det er indlejret, dens egne bevægelser fortæller os noget om, hvad der er omkring den."
Sidste artikelFysikere opdager nyt todimensionelt materiale
Næste artikelSandwichkatalysatorer giver højere aktivitet og holdbarhed
 Varme artikler
Varme artikler
-
 Opdagelse af guld nanokluster dobbelte antydninger til andre formændrende partiklerSætter sig for at bekræfte den forudsagte struktur af Gold-144, forskere opdagede et helt uventet atomarrangement (til højre). De to strukturer, beskrevet detaljeret for første gang, er kemisk identis
Opdagelse af guld nanokluster dobbelte antydninger til andre formændrende partiklerSætter sig for at bekræfte den forudsagte struktur af Gold-144, forskere opdagede et helt uventet atomarrangement (til højre). De to strukturer, beskrevet detaljeret for første gang, er kemisk identis -
 Ris, Penn State åbent center for 2-D belægningerEn atomtyk Risugle (skalastang svarer til 100 mikrometer) skabt i 2013 demonstrerede en evne til at lave fine mønstre i et hybridt grafen/hexagonalt bornitridmateriale. Risforskere ledet af materialef
Ris, Penn State åbent center for 2-D belægningerEn atomtyk Risugle (skalastang svarer til 100 mikrometer) skabt i 2013 demonstrerede en evne til at lave fine mønstre i et hybridt grafen/hexagonalt bornitridmateriale. Risforskere ledet af materialef -
 En usandsynlig brug for diamanterSmå diamanter giver videnskabsmænd nye muligheder for nøjagtige målinger af processer inde i levende celler med potentiale til at forbedre lægemiddellevering og kræftbehandling. Udgivet i Natur nano
En usandsynlig brug for diamanterSmå diamanter giver videnskabsmænd nye muligheder for nøjagtige målinger af processer inde i levende celler med potentiale til at forbedre lægemiddellevering og kræftbehandling. Udgivet i Natur nano -
 Polymerforskere sætter aftryk på nanolitografiNanopartikelarrays på en topografisk ujævn overflade. (PhysOrg.com) -- Nanolitografi, eller overflademønstre på nanoskala, er afgørende for moderne teknologi, men er i høj grad udviklet til at møn
Polymerforskere sætter aftryk på nanolitografiNanopartikelarrays på en topografisk ujævn overflade. (PhysOrg.com) -- Nanolitografi, eller overflademønstre på nanoskala, er afgørende for moderne teknologi, men er i høj grad udviklet til at møn
- MIT -robot kombinerer vision og berøring for at lære spillet Jenga
- Australien forstærker teknologien til nedkæmpelse af drone
- Opdagelse af periodiske tabeller for molekyler
- De ujævne fordele ved CSR-indsatsen
- Integrering af optiske komponenter i eksisterende chipdesign
- Seismiske bølger hjælper videnskabsmænd med at se kemiske ændringer under et vandskel


