Undersøgelse afslører, hvordan et lille molekyle fremmer fjernelse af overskydende kolesterol
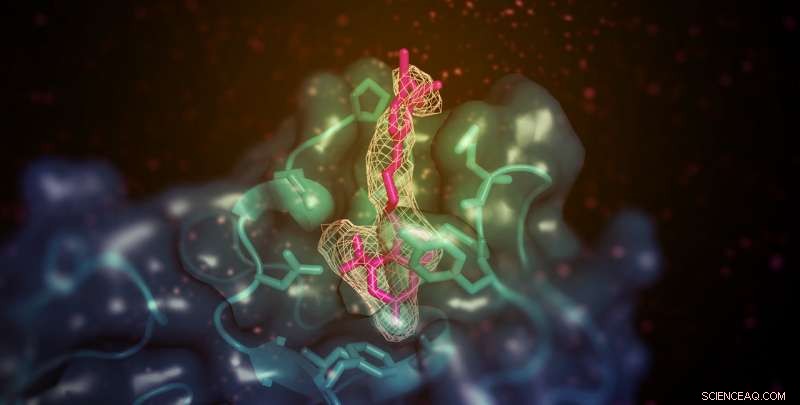
Et lille molekyle (vist her i pink) med evnen til at øge 'godt' (HDL) kolesterol i dyremodeller binder sig til det membranbindende domæne af lecithin:kolesterol acyltransferase (LCAT; vist i blågrøn). Stedet er fjernt fra enzymets aktive sted, men muliggør på en eller anden måde overførsel af lipidsubstrater fra HDL. Kredit:Kelly Manthei og Stephanie King
Forskere har bestemt strukturen af den aktiverede form af et enzym, der hjælper med at returnere overskydende kolesterol til leveren, et studie i eLife rapporter.
Forskningen afslører, hvordan et lægemiddellignende kemikalie stimulerer virkningen af lecithin:cholesterol acyltransferase (LCAT) enzymet. Det tyder også på, at fremtidige lægemidler, der bruger den samme mekanisme, kan bruges til at genoprette LCAT-funktionen hos mennesker med familiær LCAT-mangel (FLD), en sjælden arvelig sygdom, der giver dem risiko for øjenproblemer, anæmi og nyresvigt.
LCAT hjælper high-density lipoprotein (HDL) - kendt som det 'gode' kolesterol - med at fjerne kolesterol fra blodet ved at omdanne lipidet til en form, der er lettere at pakke og transportere. Der er mere end 90 kendte mutationer i LCAT, som kan forårsage enten et delvist tab af aktivitet (kendt som 'fiskeøjesygdom') eller fuldstændigt tab (FLD). Forøgelse af LCAT-aktivitet kan derfor være gavnligt ved behandling af mennesker med koronar hjertesygdom og LCAT-mangel, men de mekanismer, hvorved det kan aktiveres, er dårligt forstået.
"I dette studie, vi brugte strukturel biologi til at forstå, hvordan en patenteret LCAT-aktivator binder til LCAT, og hvordan den fremmer kolesteroltransport, " siger hovedforfatter Kelly Manthei, en postdoc ved University of Michigan Life Sciences Institute, OS. "Vi spurgte også, om forbindelsen kunne hjælpe med at genoprette aktiviteten af LCAT-enzymer, der ofte har observeret mutationer set i FLD."
Holdet brugte røntgenkrystallografi til at se på LCAT-enzymet stabiliseret i dets aktive tilstand med to forskellige kemikalier - aktivatormolekylet, og en anden forbindelse, der efterligner et substrat bundet til enzymet. De to kemikalier havde mere effekt på proteinet, når de blev præsenteret sammen, end når de blev præsenteret hver for sig, hvilket tydede på, at de binder sig til enzymet forskellige steder.
Yderligere analyse viste, at aktivatormolekylet, i modsætning til andre kendte LCAT-aktivatorer, binder til et område tæt på hvor HDL binder sig. Imidlertid, aktivatoren hjalp ikke LCAT med at binde sig til HDL mere effektivt, hvilket fik holdet til at spekulere i, at det i stedet hjælper med at overføre kolesterol og lipider til enzymets katalytiske center, så den kan omdanne den til last til transport i HDL.
Efter at have etableret denne virkemåde, forskerne testede, om dette molekyle kunne hjælpe med at genoprette kolesteroltransportfunktionen af et mutant LCAT-enzym. De lavede en version af enzymet med en mutation, der almindeligvis ses hos FLD-patienter, og testede derefter dets evne til at binde til HDL og omdanne kolesterol i nærvær eller fravær af aktivatormolekylet. De var begejstrede for at opdage, at aktivatoren delvist kunne vende tabet af aktivitet i de mutante enzymer, resulterer i sammenlignelig kolesterolomdannelse til det normale enzym.
"Vores resultater vil hjælpe videnskabsmænd med at designe forbindelser, der bedre kan målrette LCAT, så de kan være til terapeutisk fordel for hjertesygdomme og FLD-patienter, " konkluderer seniorforfatter John Tesmer, Walther professor i kræftstrukturbiologi ved Purdue University, OS. "Fremtidige bestræbelser vil være at undersøge, om patienter med andre genetiske LCAT-mutationer kan drage fordel af de forbindelser, der anvendes i denne undersøgelse, og at designe molekyler med forbedrede farmakologiske egenskaber til videre udvikling."
 Varme artikler
Varme artikler
-
 Påvisning af fermenteringsprocesser i el-genererende bakterierElektronmikroskopbillede af bakterier, der genererer elektricitet på carbonelektrodeoverflader. Kredit:National Institute for Materials Science (NIMS) Et forskerhold bestående af Akihiro Okamoto (
Påvisning af fermenteringsprocesser i el-genererende bakterierElektronmikroskopbillede af bakterier, der genererer elektricitet på carbonelektrodeoverflader. Kredit:National Institute for Materials Science (NIMS) Et forskerhold bestående af Akihiro Okamoto ( -
 Hvilken type binding forbinder to hydrogenatomer?Bindingen, der forbinder to hydrogenatomer i et brintgasmolekyle, er en klassisk kovalent binding. Bindingen er let at analysere, fordi brintatomerne kun har en proton og en elektron hver. Elektronern
Hvilken type binding forbinder to hydrogenatomer?Bindingen, der forbinder to hydrogenatomer i et brintgasmolekyle, er en klassisk kovalent binding. Bindingen er let at analysere, fordi brintatomerne kun har en proton og en elektron hver. Elektronern -
 Ambrosie-forbindelser kunne beskytte nerveceller mod AlzheimersKredit:American Chemical Society Når foråret kommer på den nordlige halvkugle, mange mennesker forbander ragweed, en primær synder i sæsonbestemte allergier. Men videnskabsmænd har måske opdaget e
Ambrosie-forbindelser kunne beskytte nerveceller mod AlzheimersKredit:American Chemical Society Når foråret kommer på den nordlige halvkugle, mange mennesker forbander ragweed, en primær synder i sæsonbestemte allergier. Men videnskabsmænd har måske opdaget e -
 Klæbemiddel dannet af bispyt og blomsterolie kan danne grundlag for ny limHonningbi på campus ved Georgia Tech Kredit:Yumiko Sakurai Honningbier bruger timer hver dag på at samle pollen og pakke det i pæne bundter fastgjort til deres bagben. Men alt det hårde arbejde k
Klæbemiddel dannet af bispyt og blomsterolie kan danne grundlag for ny limHonningbi på campus ved Georgia Tech Kredit:Yumiko Sakurai Honningbier bruger timer hver dag på at samle pollen og pakke det i pæne bundter fastgjort til deres bagben. Men alt det hårde arbejde k
- NASA fanger udviklingen af den tropiske storm Vicky i det østlige Atlanterhav
- Eliminerer revner i 3-D-printede metalkomponenter
- Instagram lancerer nye funktioner til at modvirke mobning med kunstig intelligens
- Grupper sagsøger for at forhindre Trump i at forny offshore-boringer
- Sådan beregner du procenten af Something
- Hvad to planetariske søskende kan lære os om livet


