Lægemiddelbibliotekar opdager en ny forbindelse, der kan modvirke almindelig kirurgisk komplikation
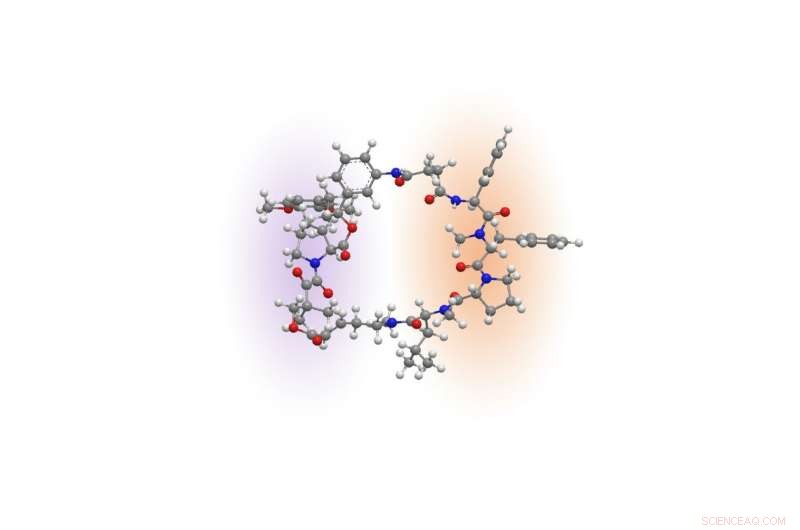
Rapadocin -molekyle. Kredit:Liu laboratorium
I en strategisk søgning, Johns Hopkins -forskere oprettede og screenede et bibliotek med 45, 000 nye forbindelser, der indeholder kemiske elementer af meget anvendte immunsystemsundertrykkende midler, og sige, at de fandt en, der kan forhindre reperfusionsskade, en vævsskadelig og almindelig komplikation af kirurgi, hjerteanfald og slagtilfælde.
Johns Hopkins -teamet kaldte dets nyopdagede sammensatte rapadocin og har indgivet patenter på det og dets familie på 45, 000 kemiske fætre. Det har også givet lægemidlet licens til Baltimore-baserede bioteknologiske selskab Rapafusyn Pharmaceuticals, som var medstifter af undersøgelsens leder, Jun O. Liu, Ph.d., professor i farmakologi og onkologi ved Johns Hopkins University School of Medicine. Forskerne advarer om, at enhver kommercialisering eller klinisk brug af lægemidlet må afvente væsentlige yderligere sikkerheds- og fordelstudier hos mennesker.
En rapport om den metode, der bruges til at oprette og identificere rapadocin, samt laboratorietest af det hos mus med reperfusionsskader i deres nyrer optrådte 10. december i Naturkemi .
"Reperfusionsskader er en almindelig komplikation efter operationen, især hos ældre, "siger Liu, der fører tilsyn med et bibliotek med tusinder af verdens nogensinde brugte lægemidler, der er banket på Johns Hopkins Drug Library.
Skaden opstår, når, efter operationen, læger frigiver klemmer på blodkar, og en bølge af iltet blod strømmer tilbage til væv, der midlertidigt blev sultet af det. Blodbølgen kan chokere vævene, der forårsager betændelse og organskader. Tilstanden kan også ske, når tilstoppede arterier åbnes efter hjerteanfald og slagtilfælde. I øjeblikket, der er en række lægemidler, der undersøges til behandling af reperfusionsskader, og nogle behandlinger, såsom blodfortyndere og antiinflammatoriske lægemidler, kan være mildt effektivt for visse typer af tilstanden.
For at finde det nye lægemiddel, Liu, der er meddirektør for Cancer Chemical and Structural Biology Program på Johns Hopkins Kimmel Cancer Center, mindede om sine postdoktorale uddannelsesår, hvor han studerede, hvordan et lægemiddel kaldet rapamycin virker. I det væsentlige, det undertrykker immunsystemet og ordineres ofte til nyretransplanterede patienter for at forhindre afvisning af deres nye organer.
"Jeg har altid troet, at rapamycin havde interessante kvaliteter, "siger Liu." Det er meget stabilt, og celler kan absorbere store mængder af det, især på grund af dets kemiske struktur. "
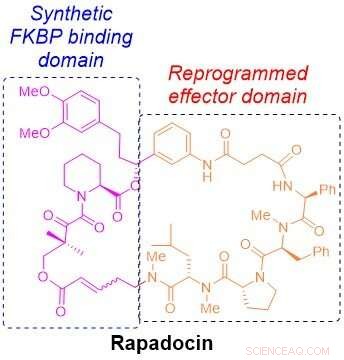
Den molekylære struktur af rapadocin. Kredit:Liu laboratorium
Kemisk, rapamycin og et andet immunsuppressivt lægemiddel, kaldet FK506, indeholder et unikt stillads, der danner næsten halvdelen af en ring. Den halvdel af ringen, kaldet FKBP-bindende domæne, er næsten identisk mellem de to lægemidler, og den anden halvdel, det såkaldte effektordomæne, er unik for hver af dem. Lægemidlers FKBP-bindende domæne giver en række fordele, herunder stabilitet og større fordeling i hele kroppen. Effektordomænet er det, der får hvert lægemiddel til at målrette mod et andet protein for at undertrykke immunsystemet eller hæmme vækst af kræftceller.
Inspireret af de unikke kemiske arkitekturer af rapamycin og FK506, Liu spekulerede på, om det var muligt at bygge lignende ringformede molekyler ved at skifte effektor-domænet for rapamycin ud og erstatte det med nye byggesten for at målrette mod andre proteiner, der er involveret i menneskelige sygdomme.
For at gøre det, Liu og hans team lavede 45, 000 kombinationer af forbindelser med et FKBP-bindende domæne og forskellige effektordomæner. "Vi kunne have lavet mange flere kombinationer, men havde kun en vis mængde ressourcer at arbejde med, "husker Liu.
Liu og hans team delte den massive pulje på 45, 000 forbindelser til 3, 000 mindre grupper og testede hver gruppe for dem, der blokerede en kemisk vej forbundet med reperfusionsskade.
Denne vej er et pumpesystem kaldet ækvilibrativ nukleosidtransportør, eller ENT, som transporterer et molekyle kaldet adenosin, en vigtig biologisk budbringer, ind i cellen. Væv, der sulter efter ilt, producerer store mængder adenosin. Adenosin beskytter celler mod skader ved at forbinde med receptorer på overfladen af celler. For at kontrollere, hvor meget og hvor længe adenosin forbinder med dets receptor, celler kan dæmpe aktiviteten af adenosin ved at sluge den ind i cellen gennem ENT -transportøren. "Så målet er at holde adenosin uden for cellen længere for at behandle reperfusionsskader, "siger Liu.
For at holde adenosin uden for cellen, forskerne ledte efter de forbindelser, der blokerede ENT-aktivitet og holdt mest adenosin uden for cellerne for at have sin vævsbeskyttende effekt så længe som muligt. En forbindelse steg til toppen af deres eksperimenter, og de kaldte det rapadocin.
I laboratorieundersøgelser af 25 mus, forskerne injicerede dem med rapadocin, fjernede den ene af deres nyrer og spændte den anden i 45 minutter; 24 timer senere, de prøvede deres blod for niveauer af kreatinin og nitrogen, som er markører for reperfusionsskade.
Dyrene, der fik rapadocin, havde en tredjedel mindre kreatinin (0,4 milligram pr. Deciliter i gennemsnit med 0,6 milligram pr. Deciliter i gennemsnit) og mindre end halvdelen af nitrogenniveauer (40 milligram pr. Deciliter i gennemsnit med 90 milligram pr. Deciliter i gennemsnit) end kontrolmus, der var givet et lægemiddel til at annullere virkningerne af rapadocin.
 Varme artikler
Varme artikler
-
 Hvorfor er sukrose et ikke-reducerende sukker?Du kan bruge sukker dagligt ved at tilføje det til dine opskrifter og varme drikke for at gøre dem sødere, men der er meget mere ved dette hvide stof end dets søde smag. Derudover har ikke alle suk
Hvorfor er sukrose et ikke-reducerende sukker?Du kan bruge sukker dagligt ved at tilføje det til dine opskrifter og varme drikke for at gøre dem sødere, men der er meget mere ved dette hvide stof end dets søde smag. Derudover har ikke alle suk -
 Kunstig fotosynteseteknologi dukker opKulstofunderstøttet wolframfrøbaseret 3D-sølv-dendritkatalysator. Kredit:Korea Institute of Science and Technology (KIST) Koreanske forskere bestræber sig på at gøre kunstig fotosynteseteknologi t
Kunstig fotosynteseteknologi dukker opKulstofunderstøttet wolframfrøbaseret 3D-sølv-dendritkatalysator. Kredit:Korea Institute of Science and Technology (KIST) Koreanske forskere bestræber sig på at gøre kunstig fotosynteseteknologi t -
 At løse et 75-årigt mysterium kan give en ny kilde til husdyrgødningTitandioxid, også kendt som titania, har fotokatalytiske egenskaber, der gør det muligt at reagere med nitrogen. Kredit:Rob Felt, Georgia Tech Løsningen på et 75-årigt materialmysterium kan en dag
At løse et 75-årigt mysterium kan give en ny kilde til husdyrgødningTitandioxid, også kendt som titania, har fotokatalytiske egenskaber, der gør det muligt at reagere med nitrogen. Kredit:Rob Felt, Georgia Tech Løsningen på et 75-årigt materialmysterium kan en dag -
 Naturens hårdeste stoffer afkodetEn illustration viser en model af blodplade-matrix-komposit i forgrunden og perlemor, et af naturens hårdeste materialer, i baggrunden. Rice University-forskere har udviklet computersimuleringer til a
Naturens hårdeste stoffer afkodetEn illustration viser en model af blodplade-matrix-komposit i forgrunden og perlemor, et af naturens hårdeste materialer, i baggrunden. Rice University-forskere har udviklet computersimuleringer til a
- Atomstruktur af bestrålede materialer ligner mere væske end glas
- CDN-analyse kaster lys over internetudviklingen
- Golfstrømmens indtrængen føder kiselalger-hot spots
- Ultraviolet kommunikation til at transformere hærens netværk
- Airbus advarer om at kunne forlade Storbritannien, hvis ingen Brexit-aftale
- Salamanders naturlige habitat


