Gennembrud skinner lys over sygdomsbekæmpende protein
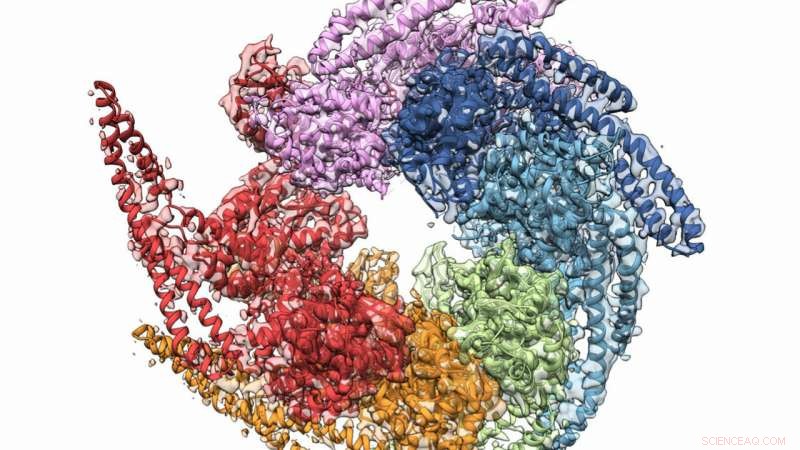
De kombinerede krystal- og kryo-elektronmikroskopistrukturer i Hsp104 adskiller sig fra svampen Calcarisporiella thermophila . Kredit:Grigore Pintilie / Stanford University
Røntgen- og elektronmikroskopiteknikker hjælper med at udfolde historien om proteinchaperoner.
En kombination af røntgenkrystallografi og kryo-elektronmikroskopi (cryo-EM) hjalp i et samarbejde for at opnå den højeste opløsning af svampeproteinet Hsp104, som kan være til hinder for dannelsen af visse degenerative sygdomme. Holdet, hvis medlemmer omfattede forskere fra US Department of Energy's (DOE) Argonne National Laboratory, verificerede også en spiralformet struktur for de proteinformede hexamerer, engang troet fladt. Resultaterne blev offentliggjort online i december 27, 2018 udgave af Struktur .
Hsp104 er et hexamerisk AAA+ protein kendt som en chaperone, som hjælper i de naturlige foldningsprocesser af proteiner til korrekt cellefunktion. Vigtigere, måske, denne klasse af hexamerer kan reparere fejlfoldede eller aggregerede proteiner, der kan føre til protein-forårsagede abnormiteter som neurodegeneration.
Varianter af disse chaperoner er almindelige blandt flercellede organismer, men Hsp104 har ingen homolog blandt mennesker og andre dyr. Selvom det er mere robust end menneskelige afledere, der kan mislykkes under cellulær stress, Hsp104 er blevet observeret ved foldning af humane proteiner.
"Vi lavede nogle eksperimenter, hvor vi udtrykte humane proteiner i gær, hvilket gør gæren syg, fordi de aggregerer. Men hvis du udtrykker Hsp104, den fra svampen Calcarisporiella thermophila , det beskytter gæren mod denne aggregeringssygdom, "sagde Argonne Distinguished FellowAndrzej Joachimiak.
Joachimiak arbejdede med et team bestående af forskere fra Argonne, University of Chicago, Stanford University og University of Pennsylvania for at få en bedre forståelse af Hsp104s struktur og funktion.
Teamet henvendte sig til Argonnes Advanced Photon Source, en DOE Office of Science brugerfacilitet, at undersøge proteinets struktur ved hjælp af røntgenkrystallografi. De undersøgte 30 forskellige prøver, herunder 14 Hsp104 chaperoner fra forskellige kilder. I denne proces, en enkelt krystal blev styrtet i flydende nitrogen og udsat for hårde røntgenstråler, hvorfra diffraktionsmønstre blev opsamlet og strukturen rekonstrueret. Kun proteinet fra Calcarisporiella svamp diffrakteret til en høj opløsning, bemærkede Joachimiak.
For bedre at forstå proteinets strukturelle forhold inden for en levende celle, de henvendte sig derefter til en undersøgelse af proteinet i opløsning. Prøver blev screenet ved hjælp af elektronmikroskopi ved University of Chicago og derefter sendt til Stanford University, hvor kryo-elektronmikroskoper indsamlede de højopløselige molekylære data, der kræves for at bestemme struktur gennem kompleks beregning. Som med krystalundersøgelsen, det Calcarisporiella prøve gav den bedste opløsning.
Nu bevæbnet med den højeste opløsning af Hsp104 i både krystalform og i opløsning, holdet var i stand til at foretage tidligere ukendte eller usikre afgørelser om proteinets egenskaber og adfærd.
Inden teamets opdagelse, biologer mente, at Hsp104 understøttede fem domæner, uafhængige dele af proteinet, der tjener specifikke funktioner. Men de nye high-fidelity-strukturer afslørede ikke kun bare fire domæner, men et klarere billede af, hvordan de forholder sig til hinanden.
N -terminaldomænet, for eksempel, menes at binde til et fejlfoldet protein og hjælpe det med at udfolde sig til en lineær form. Dette gør det muligt at passere gennem en smal central kanal i hexamer skabt af to AAA (ATPases Associated with diverse cellulære aktiviteter) domæner. Proteinet styres, eller translokeret, gennem denne kanal til den anden side af hexameren, hvor den nu har en ny mulighed for at folde korrekt.
"Folk påstod tidligere, at en anden, det C -terminale domæne, var afgørende for dannelsen af hexameren, men vi har vist, at dette ikke er sandt, "sagde Joachimiak.?" Det interagerer ikke med andre underenheder, men kan fungere som et dockingsområde for andre chaperoner for at hjælpe med at genfolde proteiner. "
Et andet vigtigt fund hjalp med at vende en langvarig tro på, at Hsp104's hexamerer var flade. Begge undersøgelsesmetoder viste utvetydigt, at de er spiralformede, hjælpe forskere med at forstå, hvordan chaperonen danner? "reparation" -kanalen.
Teamet planlægger at fortsætte udforskningen af de mange og varierede chaperoner, der findes uden for det menneskelige genom. De mener, at disse chaperoner kan tjene som en terapeutisk strategi med potentiale til bogstaveligt at opklare proteiner, der kan føre til alvorlig sygdom.
"Det er muligt, at der er andre chaperoner derude, der er bedre end vores, og at de vil være i stand til at behandle proteiner, der samler sig i hjernen og forårsager sygdomme, "sagde Joachimiak.?" Det ville virkelig være fantastisk. "
Papiret, "Struktur af Calcarisporiella thermophila Hsp104 disgregase, der modvirker forskellige proteotoksiske fejlfoldningshændelser, "fremgår af online -udgaven af tidsskriftet 27. december Struktur . Udover Joachimiak, Argonne -forsker Karolina Michalska bidrog til denne undersøgelse.
 Varme artikler
Varme artikler
-
 Undersøgelse viser, at keramik kan deformere som metaller, hvis det sintres under et elektrisk feltPurdue-forskere observerede for første gang, hvordan keramik dannet under et elektrisk felt overraskende ændrer form i stedet for at gå i stykker, når det komprimeres ved høj belastning. På billedet:U
Undersøgelse viser, at keramik kan deformere som metaller, hvis det sintres under et elektrisk feltPurdue-forskere observerede for første gang, hvordan keramik dannet under et elektrisk felt overraskende ændrer form i stedet for at gå i stykker, når det komprimeres ved høj belastning. På billedet:U -
 Borat bioaktivt glas i nanoskala:Et næste generations materiale til hudhelingBorat bioaktivt glas i nanoskala. Kredit:MA Kun For nylig, ved hjælp af en steady-state stærk magnetfelt eksperimentel enhed, forskere konstruerede bioaktivt boratglas i nanoskala (Nano-HCA@BG), s
Borat bioaktivt glas i nanoskala:Et næste generations materiale til hudhelingBorat bioaktivt glas i nanoskala. Kredit:MA Kun For nylig, ved hjælp af en steady-state stærk magnetfelt eksperimentel enhed, forskere konstruerede bioaktivt boratglas i nanoskala (Nano-HCA@BG), s -
 Ny stabil form for plutonium opdagetKredit:CC0 Public Domain Et internationalt team af forskere, ledet af Helmholtz Zentrum Dresden-Rossendorf (HZDR), har fundet en ny forbindelse af plutonium med en uventet, pentavalent oxidationst
Ny stabil form for plutonium opdagetKredit:CC0 Public Domain Et internationalt team af forskere, ledet af Helmholtz Zentrum Dresden-Rossendorf (HZDR), har fundet en ny forbindelse af plutonium med en uventet, pentavalent oxidationst -
 Sammensmeltet billedbehandling afslører skrift fra det sjette århundrede skjult inde i bogbindingEfter at have været skjult i århundreder, hemmelighederne i middelalderlige manuskripter kan snart komme frem i lyset. Ved at fusionere to billeddannelsesteknikker - synlig hyperspektral billeddannel
Sammensmeltet billedbehandling afslører skrift fra det sjette århundrede skjult inde i bogbindingEfter at have været skjult i århundreder, hemmelighederne i middelalderlige manuskripter kan snart komme frem i lyset. Ved at fusionere to billeddannelsesteknikker - synlig hyperspektral billeddannel
- Hvad er tabte kontinenter, og hvorfor opdager vi så mange?
- Hvordan vandkraft kan hjælpe med at få mere vind og sol på nettet
- Sæsonbestemte monsunregn blokerer nøglen havstrøm
- Tysk undersøgelse fremhæver CO2-fodaftryk fra videostreaming
- Biokompatibel grafentransistorarray læser cellulære signaler
- Magnetiske nanopartikler letter fjernelse af mikroforureninger fra spildevand


