Lys og peptider:Ny metode diversificerer livets naturlige byggesten

Sollys eksperiment. Reaktionerne kan udføres ved hjælp af lyset fra solen i en enkel glaskolbe. Kredit:J. Waser/EPFL
Opdagelse af nye biologiske mål er en kritisk del af vores igangværende kamp mod sygdomme. I årenes løb, forskere har gjort imponerende fremskridt mod forståelsen af biologiske systemer, konstant at identificere nye mål. Den strukturelle mangfoldighed af disse mål kræver en bred vifte af forskellige terapeutiske midler.
"Små syntetiske molekyler er stadig nøglespillere, men biomolekyler såsom peptider, proteiner og oligonukleotider er blevet et vigtigt forskningsområde, "siger professor Jérôme Waser, direktør for EPFLs laboratorium for katalyse og organisk syntese. Peptider er særligt interessante, med omkring 140 evalueret i kliniske forsøg i 2015. Dog er peptider er ofte ikke stabile i blodet og kan ikke gennemsyre celler godt, som begge reducerer deres potentielle brug som medicin.
En løsning til at overvinde disse vanskeligheder er kemisk ændring af peptidernes naturlige struktur, en proces kaldet "funktionalisering". I kemi, et molekyle "funktionaliseres" ved at tilføje kemiske grupper til det, og dermed give den nye funktioner, evner, eller ejendomme, såsom forbedret stabilitet i menneskekroppen. Imidlertid, funktionalisering af peptider er vanskelig, på grund af deres komplekse struktur.
"Hovedårsagen er manglen på selektivitet, når du forsøger at ændre et peptid:det indeholder mange positioner, der reagerer med kemikalier, resulterer i ubrugelige blandinger, "forklarer Waser." Derfor, metoder, der muliggør selektiv funktionalisering af en enkelt position i peptider, er aktivt efterspurgte for at få adgang til mere effektive myrstabile peptidbaserede lægemidler. "
Dette er, hvad Waser's lab nu har opnået, ved hjælp af "EBX reagenser" - en klasse af meget reaktive organiske forbindelser udviklet af gruppen og nu kommercielt tilgængelige. Ved hjælp af disse reagenser, forskerne konverterede den C-terminale carboxylsyre af peptider til en carbon-carbon triple binding-en alkyn (i kemisk jargon en "decarboxylativ alkynylering"). Alkyndelen er en meget værdifuld funktionel gruppe, der kan bruges til yderligere modificering af peptiderne. Det er blevet brugt i vid udstrækning til opdagelse af stoffer, materialevidenskab og kemisk biologi.
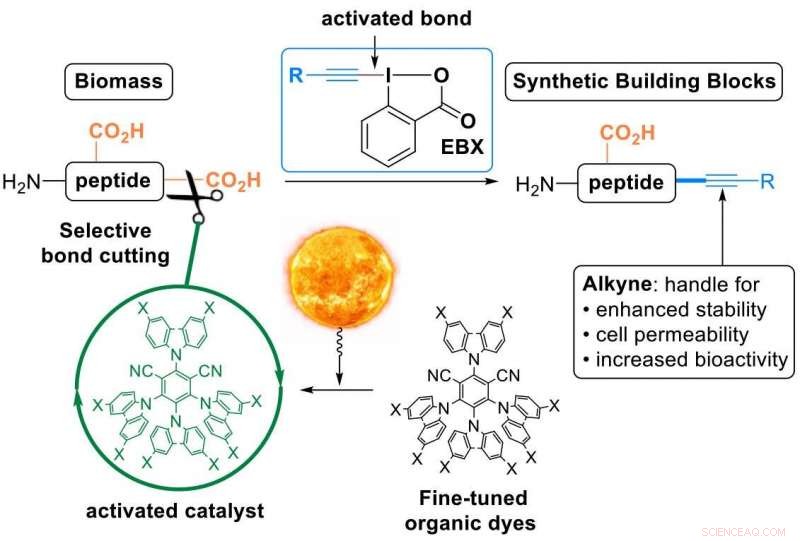
At bygge en bro mellem den naturlige og den syntetiske verden i ét trin:Ændring af peptider ved hjælp af organiske farvestoffer ophidset med synligt lys og EBX-reagenser. Kredit:J. Waser/EPFL
Peptider reagerer ikke spontant med EBX -reagenser, så forskerne måtte bruge en katalysator. For at aktivere det, forskerne vendte sig mod lys eller, i mere tekniske termer, "fotoredox -katalyse":synligt lys absorberes af katalysatoren, som derefter selektivt aktiverer én binding i de reagerende molekyler. "Brug af lys som en vedvarende energikilde til at udføre organiske reaktioner tillader en tidsmæssig og rumlig opløsning med meget milde reaktionsbetingelser, "siger Waser.
Forskerne lavede to innovationer:For det første, de designede nye finjusterede organiske farvestoffer som fotoredox-katalysatorer. Dette var vigtigt, da lysmedierede reaktioner normalt er baseret på sjældne, giftige og dyre overgangsmetalkatalysatorer.
Sekund, forskerne opnåede denne første "decarboxylative alkynylering" på native peptider. Dette er en særligt attraktiv et-trins-transformation af en naturlig forbindelse til et syntetisk derivat, da det tilbyder en platform til at ændre de fysiske og kemiske egenskaber af peptidet gennem et enkelt, let at udføre manipulation (alle "ingredienserne" skal bare blandes sammen og lade stå i naturligt lys).
Metoden kan bruges med næsten alle aminosyrer til stede på peptiderne, samtidig med at den fuldstændige selektivitet opretholdes mod den C-terminale position over peptidsidekæderne.
Med deres nye metode, forskerne var også i stand til at få derivater fra det værdifulde bioaktive peptid GRGDNP, der blokerer celler for at blive vedhæftet til fibronectin, en vigtig proces i vasodilatation af blodkar, hvilket kunne være meget nyttigt i undersøgelsen af hjerte -kar -sygdomme.
 Varme artikler
Varme artikler
-
 Kemikere skaber nyt kunstigt enzymVed hjælp af beregningskemi, kandidatstuderende Vindi M. Jayasinghe-Arachchige og Rajeev Prabhakar, professor i kemi, designet et nyt molekyle, der betydeligt kunne fremme undersøgelsen og anvendelsen
Kemikere skaber nyt kunstigt enzymVed hjælp af beregningskemi, kandidatstuderende Vindi M. Jayasinghe-Arachchige og Rajeev Prabhakar, professor i kemi, designet et nyt molekyle, der betydeligt kunne fremme undersøgelsen og anvendelsen -
 Vandoverfladen er et fantastisk sted for kemiske reaktionerKredit:Pixabay/CC0 Public Domain Ved at bruge en avanceret teknik, forskere fra RIKEN-klyngen for banebrydende forskning har påvist, at en kemisk reaktion drevet af lys finder sted ti tusinde gang
Vandoverfladen er et fantastisk sted for kemiske reaktionerKredit:Pixabay/CC0 Public Domain Ved at bruge en avanceret teknik, forskere fra RIKEN-klyngen for banebrydende forskning har påvist, at en kemisk reaktion drevet af lys finder sted ti tusinde gang -
 Geopolymerbeton:Bygning af månebaser med astronauturin og regolitFremtidige månebaser kunne bygges med 3D-printere, der blander materialer såsom måneregolith, vand og astronauters urin Kredit:ESA, Foster og partnere De moduler, som de store rumorganisationer pl
Geopolymerbeton:Bygning af månebaser med astronauturin og regolitFremtidige månebaser kunne bygges med 3D-printere, der blander materialer såsom måneregolith, vand og astronauters urin Kredit:ESA, Foster og partnere De moduler, som de store rumorganisationer pl -
 Ramme til at spore individuelle kulstofatomers vejKredit:CC0 Public Domain Som vandmolekyler i en flod, jordens kulstofatomer er altid i bevægelse. For bedre at forstå denne handling, Lawrence Livermore National Laboratory (LLNL) forskere og sam
Ramme til at spore individuelle kulstofatomers vejKredit:CC0 Public Domain Som vandmolekyler i en flod, jordens kulstofatomer er altid i bevægelse. For bedre at forstå denne handling, Lawrence Livermore National Laboratory (LLNL) forskere og sam
- 10 bedste ideer til interplanetarisk kommunikation
- Renault siger, at bestyrelsen vil mødes tirsdag for at svare på Fiat Chryslers bud
- Biomateriale kunne holde tænderne i live efter rodbehandling
- Skridt landdistrikter kan tage for at beskytte deres vandressourcer
- To mikron fyldrør opfylder to behov
- Den franske bilproducent PSA bekræfter planer om at genindtræde på det amerikanske marked inden 2…


