Kunne guld være nøglen til at lave genterapi for HIV, blodsygdomme mere tilgængelige?
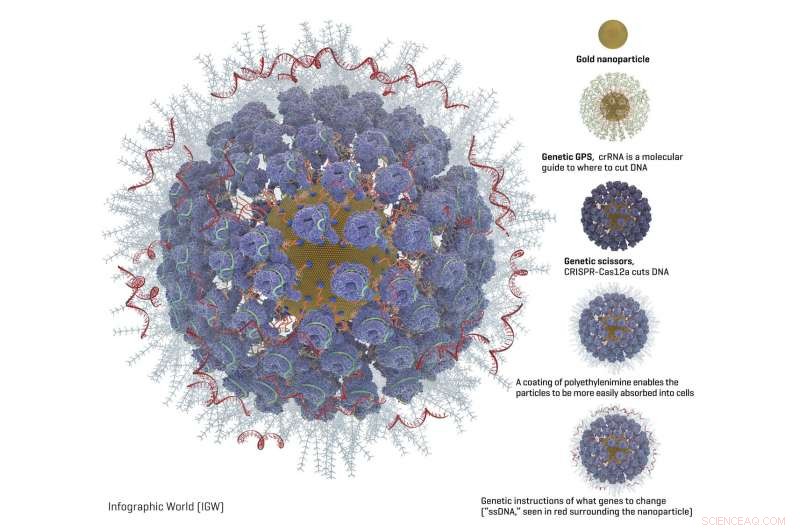
Grafik af en fuldt ladet guld nanopartikel med CRISPR og andre genredigeringsværktøjer. Kredit:Adair-laboratoriet hos Fred Hutch.
Forskere ved Fred Hutchinson Cancer Research Center tog et skridt i retning af at gøre genterapi mere praktisk ved at forenkle den måde, genredigeringsinstruktioner leveres til celler. Ved at bruge en guld nanopartikel i stedet for en inaktiveret virus, de leverede sikkert genredigeringsværktøjer i laboratoriemodeller af HIV og arvelige blodsygdomme, som rapporteret 27. maj in Naturmaterialer .
Det er første gang, at en guldnanopartikel fyldt med CRISPR er blevet brugt til at redigere gener i en sjælden, men kraftfuld undergruppe af blodstamceller, kilden til alle blodceller. Den CRISPR-bærende guldnanopartikel førte til vellykket genredigering i blodstamceller uden toksiske effekter.
"Når genterapier kommer igennem kliniske forsøg og bliver tilgængelige for patienter, vi har brug for en mere praktisk tilgang, " sagde senior forfatter Dr. Jennifer Adair, et assisterende medlem af Clinical Research Division hos Fred Hutch, tilføjer, at de nuværende metoder til at udføre genterapi er utilgængelige for millioner af mennesker rundt om i verden. "Jeg ville finde noget enklere, noget, der passivt ville levere genredigering til blodstamceller."
Mens CRISPR har gjort det hurtigere og nemmere præcist at levere genetiske modifikationer til genomet, det har stadig udfordringer. At få celler til at acceptere CRISPR-genredigeringsværktøjer involverer et lille elektrisk stød, der kan beskadige og endda dræbe cellerne. Og hvis der kræves præcise genredigeringer, så skal yderligere molekyler konstrueres til at levere dem - hvilket tilføjer omkostninger og tid.
Guldnanopartikler er et lovende alternativ, fordi overfladen af disse bittesmå kugler (omkring 1 milliardtedel af størrelsen af et gran bordsalt) gør det muligt for andre molekyler nemt at holde sig til dem og forblive vedhæftet.

Drs. Jen Adair (til venstre) og Reza Shahbazi undersøger en testbatch af guldnanopartikler i deres laboratorium hos Fred Hutch. Løsningen er rød, fordi når guldioner klumper sig sammen til nanopartikler, elektroner på overfladen begynder at oscillere og reflektere lyset i forskellige bølgelængder. Så når lys rammer guldpartiklerne, elektroner reflekterer lyset forskelligt. Kredit:Robert Hood, Fred Hutch
"Vi konstruerede guld-nanopartiklerne til hurtigt at krydse cellemembranen, undvige celleorganeller, der søger at ødelægge dem og gå lige til cellekernen for at redigere gener, " sagde Dr. Reza Shahbazi, en Fred Hutch postdoc-forsker, der har arbejdet med guldnanopartikler til lægemiddel- og genlevering i syv år.
Shahbazi lavede guldpartiklerne af guld i laboratoriekvalitet, der er renset og kommer som en væske i en lille laboratorieflaske. Han blandede det rensede guld til en opløsning, der får de individuelle guldioner til at danne små partikler, som forskerne så målte for størrelse. De fandt ud af, at en bestemt størrelse - 19 nanometer bred - var den bedste til at være stor og klæbrig nok til at tilføje genredigerende materialer til overfladen af partiklerne, mens de stadig er små nok til, at celler kan absorbere dem.
Pakket på guldpartiklerne, Fred Hutch-teamet tilføjede disse genredigeringskomponenter (diagram tilgængeligt):
- En type molekylær guide kaldet crRNA fungerer som en genetisk GPS for at vise CRISPR-komplekset, hvor i genomet det skal skæres.
- CRISPR nuklease protein, ofte kaldet "genetiske saks, " laver snittet i DNA'et. Det CRISPR-nukleaseprotein, der oftest bruges, er Cas9. Men Fred Hutch-forskerne undersøgte også Cas12a (tidligere kaldet Cpf1), fordi Cas12a laver et forskudt snit i DNA'et. Forskerne håbede, at dette ville give cellerne mulighed for mere effektivt reparere snittet og samtidig indlejre de nye genetiske instruktioner i cellen. En anden fordel ved Cas12a i forhold til Cas9 er, at det kun kræver én molekylær guide, hvilket er vigtigt på grund af pladsbegrænsninger på nanopartiklerne. Cas9 kræver to molekylære guider.
- Instruktioner for, hvilke genetiske ændringer der skal foretages ("ssDNA"). Fred Hutch-teamet valgte to nedarvede genetiske ændringer, der giver beskyttelse mod sygdom:CCR5, som beskytter mod HIV, og gammahæmoglobin, som beskytter mod blodsygdomme som seglcellesygdom og thalassæmi.
- En belægning af en polyethylenimin sværmer overfladen af partiklerne for at give dem en mere positiv ladning, hvilket gør dem i stand til lettere at blive absorberet i celler. Dette er en forbedring i forhold til en anden metode til at få celler til at tage genredigeringsværktøjer op, kaldet elektroporation, hvilket involverer let chok af cellerne for at få dem til at åbne sig og tillade de genetiske instruktioner at komme ind.
Derefter isolerede forskerne blodstamceller med en proteinmarkør på deres overflade kaldet CD34. Disse CD34-positive celler indeholder de bloddannende progenitorceller, der giver ophav til hele blodet og immunsystemet.

Når guldioner klumper sig sammen for at danne nanopartikler, elektroner på deres overflade reflekterer lys ved en anden bølgelængde - deraf den røde nuance. Laboratoriet i forgrunden indeholder guldioner, før de danner nanopartikler og er fyldt med genredigeringsværktøjer. Kredit:Robert Hood, Fred Hutch
"Disse celler fylder blod i kroppen hver dag, hvilket gør dem til en god kandidat til engangsgenterapi, fordi det vil vare hele livet, da cellerne erstatter sig selv, " sagde Adair.
Observation af menneskelige blodstamceller i en laboratorieskål, forskerne fandt ud af, at deres fuldt ladede guld-nanopartikler blev optaget naturligt af celler inden for seks timer efter at de blev tilføjet, og inden for 24 til 48 timer kunne de se genredigering ske. De observerede, at Cas12a CRISPR-proteinpartneren var bedre til at levere meget præcise genetiske redigeringer til cellerne end den mere almindeligt anvendte cas9-proteinpartner.
Genredigeringseffekten nåede et højdepunkt otte uger efter, at forskerne injicerede cellerne i musemodeller; 22 uger efter injektion var de redigerede celler der stadig. Fred Hutch-forskerne fandt også redigerede celler i knoglemarven, milt og thymus fra musemodellerne, et tegn på, at de delende blodlegemer i de organer kunne fortsætte behandlingen, uden at musene skulle behandles igen.
"Vi mener, at vi har en god kandidat til to sygdomme - HIV og hæmoglobinopatier - selvom vi også evaluerer andre sygdomsmål, hvor små genetiske ændringer kan have en stor indflydelse, samt måder at foretage større genetiske ændringer på, " sagde Adair. "Det næste skridt er at øge, hvor meget genredigering der sker i hver celle, hvilket bestemt kan lade sig gøre. Det vil gøre det tættere på at være en effektiv terapi."
I undersøgelsen, forskerne rapporterer, at 10 til 20 procent af cellerne påtog sig genredigeringerne, hvilket er en lovende start, men forskerne vil gerne sigte efter, at 50 % eller flere af cellerne bliver redigeret, som de mener vil have en god chance for at bekæmpe disse sygdomme.
 Varme artikler
Varme artikler
-
 Sådan beregnes procentdelen af ionisering Givet pHpH-værdien af en opløsning er et mål for hydrogenionerne eller protonerne, der er til stede i den opløsning. Fordi syrer er protondonorer, hver dag, kan du sige, at en opløsning, der indeholder en s
Sådan beregnes procentdelen af ionisering Givet pHpH-værdien af en opløsning er et mål for hydrogenionerne eller protonerne, der er til stede i den opløsning. Fordi syrer er protondonorer, hver dag, kan du sige, at en opløsning, der indeholder en s -
 Hvordan påvirker koncentrationen af en opløsning osmose?Osmose er en proces, der finder sted mellem to containere adskilt af en semipermeabel barriere. Hvis barrieren har porer, der er store nok til at lade vandmolekyler passere, men små nok til at blok
Hvordan påvirker koncentrationen af en opløsning osmose?Osmose er en proces, der finder sted mellem to containere adskilt af en semipermeabel barriere. Hvis barrieren har porer, der er store nok til at lade vandmolekyler passere, men små nok til at blok -
 Byg en robotål, der svømmer gennem din kropKredit:Brandeis University Som barn, fysiker Seth Fraden elskede filmen Fantastic Voyage, om en mikroskopisk ubåd, der rejser gennem en menneskelig blodbane. For næsten 10 år siden, Fraden begynd
Byg en robotål, der svømmer gennem din kropKredit:Brandeis University Som barn, fysiker Seth Fraden elskede filmen Fantastic Voyage, om en mikroskopisk ubåd, der rejser gennem en menneskelig blodbane. For næsten 10 år siden, Fraden begynd -
 Integreret brintlager til brændselscellebilerKredit:CC0 Public Domain Der er en drivkraft for at fortrænge fossile brændstoffer i elproduktion og transport med bæredygtige alternativer. En tilgang, der er blevet diskuteret i løbet af de sids
Integreret brintlager til brændselscellebilerKredit:CC0 Public Domain Der er en drivkraft for at fortrænge fossile brændstoffer i elproduktion og transport med bæredygtige alternativer. En tilgang, der er blevet diskuteret i løbet af de sids
- Realtidsovervågning kan reducere First Nations vandrådgivning med en tredjedel, undersøgelse find…
- Et skridt nærmere biotekniske erstatninger for skibe og kanaler
- Hvilke materialer Skærmmagneter?
- Undersøgelsen beskriver, hvordan bilemissioner udgør sundhedsproblemer for mennesker på verdenspl…
- Hastighedsforudsigelse for homogen kernedannelse af methanhydrat
- Store ideer i små pakker:Frøene og ormene på vej til ISS


