Kemikere viser, at det katalytiske udvalg af enzymer kan udvides
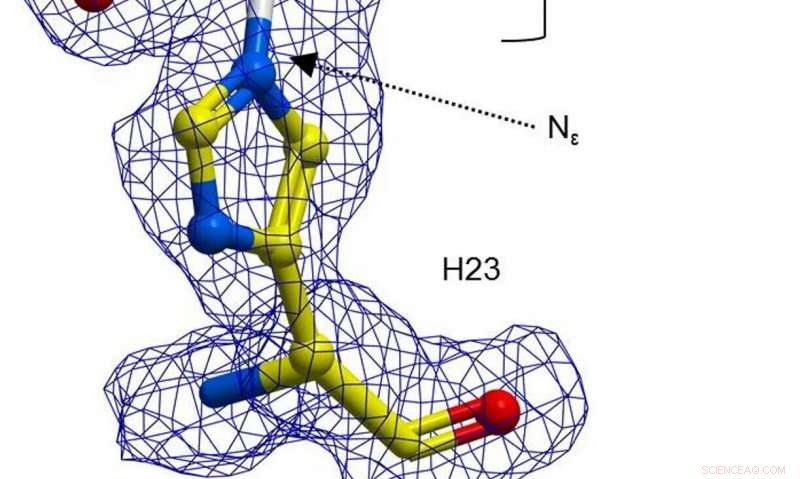
En kugle-og-stik-repræsentation af H23 fra BH32 hæmmet med 2-bromacetophenon, farvet efter atomtype med H23 carbonatomer i gul og acetophenon carboner i hvid. Klar FEM elektrondensitet (blå, kontureret ved 1σ) strækker sig mellem Nε af H23 og acetophenon. Kredit: Natur (2019). DOI:10.1038/s41586-019-1262-8
Et team af kemikere ved University of Manchester har fundet en måde at inkorporere en unormal rest i et enzym for at vise, hvordan det katalytiske udvalg af enzymer kan udvides. I deres papir offentliggjort i tidsskriftet Natur , gruppen beskriver en udvidelse af rækken af katalytiske enzymer, der kan bruges til at give en bredere vifte af sidekæder til katalyse - ved at bruge et udvidet "alfabet" af aminosyrer. Adam Nelson, med University of Leeds, har udgivet et nyheds- og synspunkterforskningspapir, der diskuterer holdets arbejde i samme tidsskriftsudgave.
Som Nelson bemærker, der er ikke ret mange naturlige aminosyrerester, der kan bruges af enzymer til at katalysere reaktioner - han bemærker, at der kun er 20 slags, der kan bruges til at bygge sådanne enzymer. Denne mangel på muligheder har fået forskerne til at overveje, om rækken af aminosyrer, der kunne bruges af enzymer for at muliggøre flere katalytiske reaktioner, kunne udvides - måske ved at bruge det, forskerne beskriver som et "alfabet" af aminosyrer, der leverer en bredere forskellige sidekæder, der kan bruges til katalyse. I denne nye indsats, forskerne brugte et sådant udvidet alfabet af aminosyrer til at udvide rækken af muligheder. De rapporterer, at ved at gøre det, de var i stand til at konstruere et enzym ved hjælp af medlemmer af en unaturlig katalytisk gruppe og viste, at det kunne føre til forbedringer ved hjælp af en tilgang kaldet rettet evolution.
I deres arbejde, forskerne valgte at ombygge et enzym for at gøre det til en mere effektiv katalysator - de startede med at bemærke, at en histidinaminosyrerest i enzymet BH32 kan danne en mellemliggende acylenzymforbindelse. Dette mellemprodukt blev hydrolyseret for at skabe et produkt fra reaktionen, men resultatet blev ikke som forventet. Holdet brugte derefter rettet evolution til at optimere rollen for Nδ-methylhistidin. Det involverede en række tilgange til force mutationer. Som resultat, holdet opdagede en variant kaldet OE1.3, som test viste var mere effektiv. Holdet fortsatte med mere rettet udvikling og nåede til sidst frem til OE1.4 - et enzym, der viste forbedret katalytisk aktivitet.
© 2019 Science X Network
 Varme artikler
Varme artikler
-
 En mulig afslutning på evige kemikalierKredit:Marla Bereni/UCR Syntetiske kemikalier kendt som per- og polyfluoralkyler, eller PFAS, indeholder bindinger mellem kulstof- og fluoratomer, der anses for at være de stærkeste i organisk kem
En mulig afslutning på evige kemikalierKredit:Marla Bereni/UCR Syntetiske kemikalier kendt som per- og polyfluoralkyler, eller PFAS, indeholder bindinger mellem kulstof- og fluoratomer, der anses for at være de stærkeste i organisk kem -
 Hybrid katalysator med høj enantiomer selektivitetHybridkatalysatoren er dannet ved at kombinere en enkelt struktureret, kommercielt tilgængeligt rhodium og en let tilgængelig organisk katalysator gennem ioniske interaktioner. Kredit:Hokkaido Univers
Hybrid katalysator med høj enantiomer selektivitetHybridkatalysatoren er dannet ved at kombinere en enkelt struktureret, kommercielt tilgængeligt rhodium og en let tilgængelig organisk katalysator gennem ioniske interaktioner. Kredit:Hokkaido Univers -
 Forskningsteam afdækker ekstraordinære egenskaber ved strontiumniobatForskere ledet af professor T Venky Venkatesan (første række, centrum), Direktør for NUSNNI, afdækkede ekstraordinære egenskaber ved halvledermateriale strontiumniobat. Kredit:National University of S
Forskningsteam afdækker ekstraordinære egenskaber ved strontiumniobatForskere ledet af professor T Venky Venkatesan (første række, centrum), Direktør for NUSNNI, afdækkede ekstraordinære egenskaber ved halvledermateriale strontiumniobat. Kredit:National University of S -
 Forskning i edderkoppelim løser klæbrige problemerEn orb edderkop, ekstraordinær limmaskine, på arbejde på et web. Kredit:University of Akron Har du nogensinde spekuleret på, hvorfor maling skræller af væggen under sommerens høje luftfugtighed? D
Forskning i edderkoppelim løser klæbrige problemerEn orb edderkop, ekstraordinær limmaskine, på arbejde på et web. Kredit:University of Akron Har du nogensinde spekuleret på, hvorfor maling skræller af væggen under sommerens høje luftfugtighed? D
- Elektronespektrometer dekrypterer kvantemekaniske virkninger
- Billede:Ice Cube modulære eksperimentblokke på vej til ISS
- Et videnskabeligt datingspil - biologer spiller RNA-protein-matchmakere
- Flåder af autonome satellitter til at koordinere opgaver indbyrdes
- Undersøgelse viser, at Pinterest har en bias mod vaccination
- Rumstations besætning skal flytte Soyuz, give plads til nye besætningsmedlemmer


