Forskere afslører bindingshemmeligheden bag proteinsuperlim
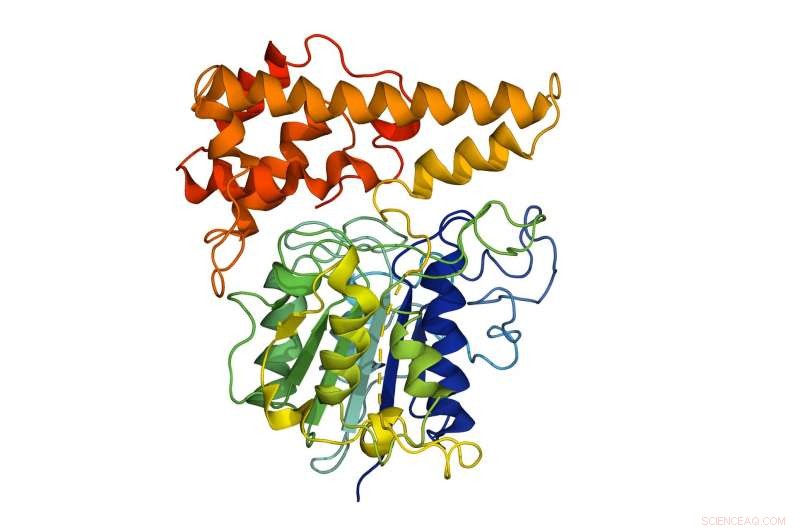
Den molekylære struktur af peptidligasen ekstraheret fra den kinesiske viol (Viola yedoensis), som den laboratoriedyrkede rekombinante peptidligase var afledt af. Dette laboratoriedyrkede peptid kan hjælpe med udviklingen af lægemidler fremstillet af komponenter taget fra levende organismer, da det overvinder begrænsningerne ved de nuværende metoder, såsom biprodukter eller giftige molekyler, der kan ændre et lægemiddels funktion og virkning. Kredit:Nanyang Technological University
Forskere fra Nanyang Technological University, Singapore (NTU Singapore) har peget på, hvordan en særlig klasse af plante-afledte enzymer, kendt som peptidligaser, arbejde for at binde proteiner sammen. Sådan binding er en vigtig proces i udviklingen af lægemidler, for eksempel ved specifikt at knytte et kemoterapilægemiddel til et antistof, der genkender tumormarkører for at målrette cancerceller.
Mere bredt, peptidligaser er et nyttigt værktøj i bioteknologiske og biomedicinske anvendelser såsom proteinmærkning, billeddannelse og sporing af proteiner i kroppen.
NTU Singapore-forskere har vist, at hemmeligheden bag en peptidligases 'superlim'-egenskab ligger i to specifikke områder af enzymet, som giver det evnen til at binde sig til andre molekyler, og for at ændre den hastighed, hvormed det virker.
NTU-teamet ledet af lektor Julien Lescar og professor James Tam fra NTU School of Biological Sciences brugte deres nyfundne viden til at udvikle en ny laboratorieskabt peptidligase baseret på genetisk information fra den kinesiske viol ( Viola yedoensis ), en lægeplante med antibiotiske og antiinflammatoriske egenskaber.
Den kunstigt skabte peptidligase, også kendt som en rekombinant peptidligase, kan hjælpe med udviklingen af lægemidler fremstillet af komponenter taget fra levende organismer, da det overvinder begrænsningerne ved de nuværende metoder, såsom biprodukter eller giftige molekyler, der kan ændre et lægemiddels funktion og virkning.
Resultaterne blev offentliggjort i april i Proceedings of the National Academy of Sciences ( PNAS ).
Lektor Julien Lescar, som også er baseret på NTU Institut for Strukturel Biologi (NISB), sagde, "Vi har brugt det, vi har lært i naturen, til at konstruere et rekombinant enzym i laboratoriet. Det binder sig til et specifikt protein, som så forbindes til et andet specifikt protein eller molekyle. Denne nye måde at gøre tingene på kunne understøtte bedre diagnostiske tests eller anti-kræftmedicin."
I øjeblikket, under udvikling af lægemidler, proteinmolekyler sys kemisk sammen. Selvom dette er effektivt, processen efterlader biprodukter, der kan ændre funktionen af slutproduktet.
Planteafledte peptidligaser har vist sig at være et mere pålideligt protein 'superlim' end ligaser afledt af bakterier, eller brugen af kemikalier til at binde proteiner sammen. Assoc Prof Lescar bemærkede, at planteekstraherede enzymer kan bære sporforurenende stoffer, som igen kunne udløse allergier, og tilgængeligheden af enzymet er afhængig af vellykket dyrkning og høst. I modsætning, det nye NTU-udviklede rekombinante enzym kan produceres i laboratorier i store mængder uden biprodukter.
Professor James Tam, som også er i NISB, sagde, "I meget enkle vendinger, vores arbejde med at skabe disse ligaser giver en forbedret platform for præcision biofremstilling af lægemidler, diagnostik og biomaterialer."
At tage et blad ud af naturens bog

(L-R) Dr. Hemu Xinya og Dr. Abbas El Sahili, NTU-forskere fra Institut for Biologiske Videnskaber, er en del af NTU-teamet, der skabte den laboratoriedyrkede rekombinante peptidligase. Ved at bruge maskinen på billedet, de har fundet ud af, at det NTU-skabte rekombinante enzym er 3, 000 gange mere effektiv end tre andre kendte typer ligaser. Kredit:Nanyang Technological University
NTU-holdet studerede den genetiske information om enzymer udvundet fra den kinesiske viol ( Viola yedoensis ) og Canada violet ( Viola canadensis ). I stedet for at teste effektiviteten af disse ekstraherede enzymer, forskerne konstruerede fem rekombinante enzymprøver ved at indsætte enzymernes gener i en insektcellekultur. Af de fem prøver, tre er peptidligaser. De to andre er proteaser, som er enzymer, der spalter proteinmolekyler til mindre peptidkæder.
Forskerne fandt ud af, at en af de rekombinante peptidligaseprøver, VyPAL2, har exceptionelle bindeegenskaber, og er 3, 000 gange mere effektiv end tre andre kendte typer ligaser.
Gennem en strukturel analyse af VyPAL2, NTU-holdet indsnævrede derefter "kontrolcentrene" af sin superlim-ejendom til to specifikke regioner, som de kaldte LAD1 og LAD2. LAD1 påvirker hastigheden af enzymatisk aktivitet, mens LAD2 bestemmer om enzymet udviser ligase- eller proteaseaktivitet.
Forvandling af proteaser til peptidligaser
Another discovery stemming from the knowledge of the peptide ligase's molecular mechanism is a method to convert it from being a cutter (a protease) into a joiner (peptide ligase). This can be done by introducing mutations into the LAD1 and LAD2 regions of a protease.
Knowing this conversion process opens up possibilities for identifying novel interesting peptide ligases by simply trawling through protein sequence databases, said Assoc Prof Lescar.
"When you have tens of thousands of proteases, and only a few known peptide ligases, trawling through the sequence databases with the LAD1 and LAD2 regions as the search criteria could lead to the discovery of more proteases that can be converted into peptide ligases. It's like a fishing expedition, but at least now we know where to fish."
Fremtidige ansøgninger
The team recently received funding from NTUitive, NTU's innovation and enterprise company, and is now working to develop the recombinant enzyme into a product. The product will be eventually sold at Epitoire, a start-up founded by Assoc Prof Lescar. The start-up sells DNA, RNA and protein reagents for academics and researchers who wish to do protein modification.
The team is also partnering both local and overseas medical schools and health institutions to use this recombinant enzyme in diagnostic imaging, such as brain tumor imaging during a surgery.
A patent has been filed for the creation of the recombinant enzyme, as well as the mechanism that converts a protease into a ligase.
 Varme artikler
Varme artikler
-
 Bouncende bobler ryster emulsionsundersøgelserHøjhastighedskamera snapshots og simuleringer af bobler, der hopper fra vand-luft-grænseflader, kan bruges til at detektere spormængder af forurenende stoffer. Kredit:Ivan Vakarelski Nogle af de h
Bouncende bobler ryster emulsionsundersøgelserHøjhastighedskamera snapshots og simuleringer af bobler, der hopper fra vand-luft-grænseflader, kan bruges til at detektere spormængder af forurenende stoffer. Kredit:Ivan Vakarelski Nogle af de h -
 Ethylensensor kan hjælpe med at overvåge plantesundhedKredit:American Chemical Society For at kontrollere blomstring og frugtmodning, planter frigiver det gasformige hormon ethylen. Miljøbetingelser, herunder tørke, saltindhold og patogener, kan også
Ethylensensor kan hjælpe med at overvåge plantesundhedKredit:American Chemical Society For at kontrollere blomstring og frugtmodning, planter frigiver det gasformige hormon ethylen. Miljøbetingelser, herunder tørke, saltindhold og patogener, kan også -
 Supercomputing forbedrer biomassebrændstofkonverteringCo-opløsningsmidler THF og vand får lignin til at adskille sig fra sig selv og cellulose, udvides til en tilfældig spole. Kredit:Charles Cai/UCR Brændstoffer fremstillet af landbrugs- eller skovbr
Supercomputing forbedrer biomassebrændstofkonverteringCo-opløsningsmidler THF og vand får lignin til at adskille sig fra sig selv og cellulose, udvides til en tilfældig spole. Kredit:Charles Cai/UCR Brændstoffer fremstillet af landbrugs- eller skovbr -
 Ingredienser fundet i sæbe kan ændre fugtigheden af din hudfyr tysk, assisterende professor i biomedicinsk teknik ved Binghamton University, State University of New York, sammen med andre forskere, viste, at fugtigheden af dette hudlag kan kontrolleres genn
Ingredienser fundet i sæbe kan ændre fugtigheden af din hudfyr tysk, assisterende professor i biomedicinsk teknik ved Binghamton University, State University of New York, sammen med andre forskere, viste, at fugtigheden af dette hudlag kan kontrolleres genn
- Team bruger maskinlæring til at hjælpe med at fortælle, hvilke naturbrande der vil brænde ude af…
- Støv fra Sahara forårsagede en stigning i europæisk luftforurening
- Geologer afslører Antarktis fossile skove
- Forsøg med nye robotubåde begynder i Skotland for at reducere omkostninger og miljøpåvirkning af…
- Thomas Cook flyselskab Condor bliver ved med at flyve, men søger statslån
- Et træ, der ejer sig selv, vokser i Athen,


