Modificeret enzym kan øge anden generations ethanolproduktion

Ved at bruge et protein produceret af en svamp, der lever i Amazonas, Brasilianske forskere udviklede et molekyle, der er i stand til at øge glukosefrigivelsen fra biomasse til fermentering (sukkerrørsbagasse ved Santa Fé-møllen i Nova Europa, São Paulo stat. Kredit:Eduardo Cesar / Pesquisa FAPESP magazine
En af hovedudfordringerne ved produktion af anden generation af biobrændstoffer er at identificere enzymer produceret af mikroorganismer til brug i en cocktail af enzymer til at katalysere biomassehydrolyse, hvor enzymerne virker sammen for at nedbryde kulhydraterne i sukkerrørsaffald og bagasse. for eksempel, og konverter dem til simple sukkerarter til gæring.
En gruppe forskere ved University of Campinas (UNICAMP), arbejder i partnerskab med kolleger ved Brazilian Biorenewables National Laboratory (LNBR) i Campinas, São Paulo -staten, Brasilien, har opdaget det Trichoderma harzianum , en svamp fundet i Amazonas, producerer et enzym med potentiale til at spille en nøglerolle i enzymcocktails.
Enzymet, som kaldes β-glucosidase og tilhører glycosidhydrolasefamilie 1 (GH1), virker i det sidste trin af biomassenedbrydning for at producere fri glukose til fermentering og omdannelse til ethanol. I laboratoriet, imidlertid, forskerne observerede, at høje niveauer af glucose hæmmede aktiviteten af β-glucosidase.
"Vi fandt også ud af, at enzymets optimale katalytiske aktivitet fandt sted ved 40 °C. Dette repræsenterede endnu en hindring for brugen af enzymet, fordi det i industrielle omgivelser, den enzymatiske hydrolyse af biomasse udføres ved højere temperaturer, typisk omkring 50 °C, " sagde Clelton Aparecido dos Santos, en postdoc-forsker ved UNICAMPs Center for Molekylærbiologi og Genteknologi (CBMEG) med et stipendium fra FAPESP.
Baseret på en analyse af enzymets struktur kombineret med genomik og molekylærbiologiske teknikker, forskerne var i stand til at ændre strukturen for at løse disse problemer og betydeligt forbedre dens biomassenedbrydningseffektivitet.
Undersøgelsen er et resultat af et projekt med en almindelig forskningsbevilling fra FAPESP og et tematisk projekt også støttet af FAPESP. Resultaterne er offentliggjort i tidsskriftet Videnskabelige rapporter .
"Det modificerede protein, vi udviklede, viste sig at være langt mere effektivt end det umodificerede enzym og kan bruges til at supplere de enzymcocktails, der sælges i dag for at nedbryde biomasse og producere andengenerations biobrændstoffer, " fortalte Santos.
For at nå frem til det modificerede protein, forskerne sammenlignede indledningsvis krystalstrukturen af det originale molekyle med strukturer af andre vildtype-β-glucosidaser i GH1- og GH3-glycosidhydrolasefamilierne. Resultaterne af analysen viste, at glucosetolerante GH1 glucosidaser havde en dybere og smallere substratkanal end andre β-glucosidaser, og at denne kanal begrænsede glucoseadgang til enzymets aktive sted.
Mindre glucosetolerante β-glucosidaser havde en mere lavvandet, men bredere indgangskanal til det aktive sted, lader mere af glucosen produceret af disse enzymer komme ind i det sidste trin af biomassenedbrydning. Tilbageholdt glukose blokerer proteinets kanal og reducerer dets katalytiske aktivitet.
Baseret på denne observation, forskerne brugte en molekylærbiologisk teknik kendt som site-directed mutagenese til at erstatte to aminosyrer, der kunne fungere som "gatekeepere" ved indgangen til enzymets aktive sted, lukker glukose ind eller blokerer det. Analyse af deres eksperimenter viste, at ændringen indsnævrede kanalen til det aktive websted.
"Det mutante enzyms aktive sted krympede til en størrelse svarende til den for de glucosetolerante GH1 β-glucosidaser, " sagde Santos.
Forbedret effektivitet
Forskerne udførte en række eksperimenter for at måle det forbedrede proteins ydeevne til at nedbryde biomasse, især sukkerrør bagasse, et agroindustrielt affald med stort potentiale for rentabel anvendelse i Brasilien. Under en forskningspraktik i udlandet med et stipendium fra São Paulo Research Foundation - FAPESP, Santos arbejdede med en forskergruppe ledet af Paul Dupree, professor ved University of Cambridge i Storbritannien, på en analyse af det skræddersyede enzyms glucosefrigivelseseffektivitet, når forskellige kilder til plantebiomasse blev omdannet.
Analysen viste, at den katalytiske effektivitet af det modificerede enzym var 300 % højere end vildtype-enzymets med hensyn til glucosefrigivelse. I øvrigt, det var mere glukosetolerant, så der blev frigivet mere glukose fra alle de testede plantebiomasseråvarer. Mutationen forbedrede også enzymets termiske stabilitet under fermentering.
"Mutation af de to aminosyrer på det aktive sted gjorde enzymet supereffektivt. Det er klar til industriel anvendelse, "sagde Anete Pereira de Souza, en professor ved UNICAMP og hovedefterforsker for projektet. "En af enzymets fordele er, at det er produceret in vitro og ikke fra en modificeret svamp eller anden organisme, så det kan masseproduceres til relativt lave omkostninger."
Sidste artikelStiller ind på morgendagens LCD-skærme:Udforsk den nye IGZO-11-halvleder
Næste artikelDundee lab løser HOIL-1 mysteriet
 Varme artikler
Varme artikler
-
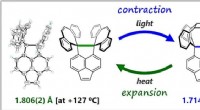 Kulstof-kulstof kovalente bindinger langt mere fleksible end antagetMolekylerne syntetiseret og analyseret af forskergruppen. I grøn og blå er den fleksible C-C enkeltbinding (Takuya Shimajiri, Takanori Suzuki, Yusuke Ishigaki, Angewandte Chemie International Edition,
Kulstof-kulstof kovalente bindinger langt mere fleksible end antagetMolekylerne syntetiseret og analyseret af forskergruppen. I grøn og blå er den fleksible C-C enkeltbinding (Takuya Shimajiri, Takanori Suzuki, Yusuke Ishigaki, Angewandte Chemie International Edition, -
 Energieffektiv solfotokemi med selvlysende solcellekoncentratorerKredit:Wiley Solen er den mest bæredygtige energikilde på vores planet og kan bruges til at drive fotokemiske reaktioner. I journalen Angewandte Chemie , videnskabsmænd præsenterer en bredt anve
Energieffektiv solfotokemi med selvlysende solcellekoncentratorerKredit:Wiley Solen er den mest bæredygtige energikilde på vores planet og kan bruges til at drive fotokemiske reaktioner. I journalen Angewandte Chemie , videnskabsmænd præsenterer en bredt anve -
 Nye fotokatalysatorer kan udføre solcelledrevet omdannelse af kuldioxid til brændstofVedtagelse af den fotokatalytiske omdannelse af CO2 til brændstof i højemissionsanlæg ville være yderst gavnlig for både miljøet og økonomien. Kredit:Shutterstock Forskere ved Daegu Gyeongbuk Inst
Nye fotokatalysatorer kan udføre solcelledrevet omdannelse af kuldioxid til brændstofVedtagelse af den fotokatalytiske omdannelse af CO2 til brændstof i højemissionsanlæg ville være yderst gavnlig for både miljøet og økonomien. Kredit:Shutterstock Forskere ved Daegu Gyeongbuk Inst -
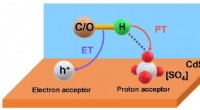 Ny metode øger syngasgenerering fra biopolyolerSkematisk mekanisme af den fotoinducerede PCET-proces over [SO4]/CdS. Kredit:DICP Fotokatalytisk biomassekonvertering er en ideel måde at generere syngas (H 2 og CO) via C-C-bindingsspaltning, s
Ny metode øger syngasgenerering fra biopolyolerSkematisk mekanisme af den fotoinducerede PCET-proces over [SO4]/CdS. Kredit:DICP Fotokatalytisk biomassekonvertering er en ideel måde at generere syngas (H 2 og CO) via C-C-bindingsspaltning, s
- Sådan køber du et nøjagtigt rumtermometer
- Kan flåter lægge æg på mennesker?
- California lovgivere øje back-up strøm til mobiltelefon tårne
- Efterhånden som menneskehedens forhold til AI vokser, eksperter kræver beskyttende rammer
- Forskere udvikler antibakteriel gelbandage ved hjælp af durian-skaller
- En pause -knap til lette partikler


