Review understreger kraften i simple fysiske modeller til komplekse proteinmaskiner

Snapshots fra en simulering, der afslører den mekanisme, hvorved hepatitis C-virus helicase bryder dobbelte DNA-strenge. De to motoriske domæner går langs den øvre streng ved at anvende inchworm-translokationsmekanismen. Det tredje domæne fungerer som en kile, der mekanisk adskiller duplexen (fra fig. 14). Kredit:Kanazawa University
Den levende celle kan ses som en fabrik, hvor proteinmaskiner står for forskellige processer, såsom transport af materiale inde i cellen eller operationer med andre makromolekyler som DNA. Deres drift er typisk drevet af ATP-molekyler, den største energibærer i biologiske celler. Den kemiske energi opnået gennem ATP-hydrolyse bruges af en proteinmaskine til cyklisk at ændre sin form og dermed til at udføre en bestemt funktion. Derfor, at løse funktionelle konformationelle ændringer i proteiner er en stor udfordring, med fundamental betydning for forståelse og kontrol af biologiske enkeltmolekyle motorer og maskiner.
Kompleksiteten af interaktioner mellem atomer i en proteinmaskine er så høj, at selv verdens bedste supercomputere ikke kan gengive kun en af deres operationscyklusser. I denne anmeldelsesartikel, det er imidlertid påvist, at væsentlige aspekter af driften af sådanne naturlige nano-enheder allerede kan afsløres ved at udforske meget simple mekaniske modeller af proteiner, ved at behandle sådanne makromolekyler som elastiske netværk opnået ved at forbinde partikler med et sæt elastiske fjedre.
Forfatterne, professor Alexander Mikhailov og adjunkt Holger Flechsig fra Nano Life Science Institute på Kanazawa University i Japan, hævder, at elastiske netværk svarende til proteinmaskiner med funktionel dynamik har særlige egenskaber, opstod i den biologiske udviklingsproces. På trods af en tilsyneladende kompleksitet, indre bevægelser i sådanne systemer forløber på en ordnet måde, som om den blev ført langs skjulte jernbaneskinner. Dermed, en molekylær maskine opfører sig som makroskopiske mekaniske anordninger med meget koordinerede bevægelser af deres dele. Dette sikrer, at cellefabrikken kan fungere robust på trods af kraftige udsving på nanoskala.
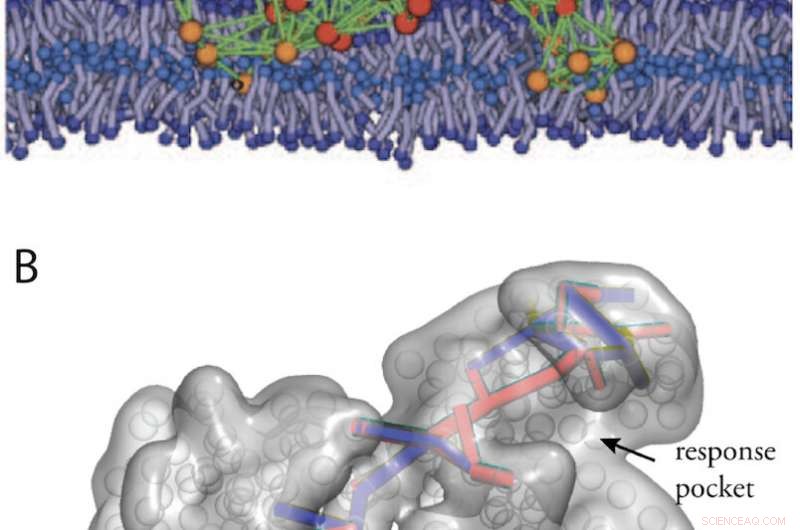
Kunstige proteinlignende strukturer opnået ved i silico udvikling. (A) En modelproteinmaskine i en biologisk membran (fra fig. 11). (B) Kommunikationsveje i en designet allosterisk struktur (fra ref. 34). Kredit:Kanazawa University
Ved at bruge denne tilgang, simuleringer, der dækker hele operationscyklusser, kunne udføres, og de første molekylære film af proteinmaskiner blev således opnået. Som et eksempel, Fig.1 fra den originale 2010-publikation af forfatterne viser, hvordan helicasemotorproteinet fra hepatitis C-virussen - en hoveddel af dets replikationsmaskineri og et vigtigt farmakologisk mål for antivirale lægemidler - aktivt bevæger sig langs DNA'et og mekanisk udpakker det.
Kunstige proteinlignende strukturer med maskinegenskaber kunne desuden designes ved at køre en computerudvikling af elastiske netværk. I fig. 2 er vist to eksempler, en designet modelmaskine, der opererer inden for en biologisk membran, og en maskine, der udviser allosterisk kommunikation.
Denne oversigtsartikel præsenterer et nyt perspektiv i forståelsen af biologiske cellers komplekse maskineri. Det baner også vejen for nye tilgange til design af kunstige nanomaskiner - en opgave med stort potentiale for fremtidige bioteknologiske anvendelser.
 Varme artikler
Varme artikler
-
 En ny metode til at genbruge plast sammenForskere har med succes blandet forskellige typer plastik, der skal genbruges sammen, at give en løsning på miljøproblemet med plastaffald og tilføje økonomisk værdi til plastmaterialer. Kredit:Limin
En ny metode til at genbruge plast sammenForskere har med succes blandet forskellige typer plastik, der skal genbruges sammen, at give en løsning på miljøproblemet med plastaffald og tilføje økonomisk værdi til plastmaterialer. Kredit:Limin -
 Den serendipitære opdagelse af en ny grøn kemimetodeDowex H + kationbytterharpiks før (venstre) og efter (højre) tørring i ovn ved 120 °C natten over. Kredit:University of Eastern Finland Dr. Petri Turhanen arbejdede på en syntese af en modificer
Den serendipitære opdagelse af en ny grøn kemimetodeDowex H + kationbytterharpiks før (venstre) og efter (højre) tørring i ovn ved 120 °C natten over. Kredit:University of Eastern Finland Dr. Petri Turhanen arbejdede på en syntese af en modificer -
 Metaloxid-infunderede membraner kunne tilbyde et lavenergialternativ til kemisk adskillelseEt elementært kort indsamlet med elektronmikroskopi af et brudt tværsnit af hybrid hulfibermembran med en radius på omkring 500 μm. Grønne prikker angiver placeringen af metaloxidet i membranen. Det
Metaloxid-infunderede membraner kunne tilbyde et lavenergialternativ til kemisk adskillelseEt elementært kort indsamlet med elektronmikroskopi af et brudt tværsnit af hybrid hulfibermembran med en radius på omkring 500 μm. Grønne prikker angiver placeringen af metaloxidet i membranen. Det -
 Et-atoms switch overlader fluorescerende farvestofferØverst, en sekvens viser designet af thio-caged farvestoffer designet på Rice University til at blive udløst af synligt lys. I bunden, konfokal og superopløsningsbilleddannelse af en lipiddråbe i leve
Et-atoms switch overlader fluorescerende farvestofferØverst, en sekvens viser designet af thio-caged farvestoffer designet på Rice University til at blive udløst af synligt lys. I bunden, konfokal og superopløsningsbilleddannelse af en lipiddråbe i leve
- Overvågning af elektrisk strøm giver høj præcision, sensorfri midler til at styre ventiler og lå…
- Færret på tværs:At finde ud af ukonventionel spintransport i kvante -centrifugeringsvæsker
- Hvordan kvantecomputere kunne stjæle din bitcoin
- Er DNA'et mellem gener virkelig skrammel?
- Dual-Purpose nanopartikler spotter resterende tumorer, Forbedrer kræftkirurgi
- Biomedicinsk gennembrud:Carbon nanopartikler, du kan lave derhjemme


