Hvordan naturen bygger brintproducerende enzymer

Thomas Happe (til venstre) og Oliver Lampret sigter på at forstå, hvordan brintproducerende enzymer fungerer i detaljer. Kredit:RUB, Kramer
Et hold fra Ruhr-Universität Bochum og University of Oxford har opdaget, hvordan hydrogen-producerende enzymer, kaldet hydrogenaser, aktiveres under deres biosyntese. De viste, hvordan cofaktoren - en del af det aktive center og også hjertet af enzymet - introduceres indeni.
Hydrogenaser er af bioteknologisk interesse, da de er i stand til effektivt at producere brint. "For at optimere dem til en industriel anvendelse, vi skal først forstå processen med, hvordan proteinskallen optager og aktiverer den kemiske cofaktor, " siger professor Thomas Happe. Et hold ledet af Oliver Lampret og Thomas Happe fra den Bochum-baserede Photobiotechnology Research Group offentliggjorde resultaterne i tidsskriftet Proceedings of the National Academy of Sciences .
Forskerne undersøgte undergruppen af [FeFe]-hydrogenaser, som er de mest effektive brintproducenter. I naturen, de kan findes i grønalger. Inden for deres protein stilladser, enzymerne har et aktivt center, den såkaldte H-klynge, hvor brinten produceres. Den består af to strukturelle elementer:en klynge, der indeholder fire jern- og fire svovlatomer, og den katalytiske kofaktor, som består af to jern- og to svovlatomer. "Denne cofaktor er bindesten i enzymet, " forklarer Oliver Lampret.
Sidste trin af biosyntese
I naturen, cofaktoren inkorporeres efterfølgende i enzymet efter biosyntesen af proteinstilladset - en meget kompleks proces. Først da er hydrogenasen katalytisk aktiv. Forskerne afklarede den præcise sekvens af processen ved hjælp af proteinteknologi, proteinfilm elektrokemi og infrarød spektroskopi.
Holdet viste, at den negativt ladede cofaktor specifikt transporteres gennem en positivt ladet modningskanal ind i det indre af enzymet, før den er fast forankret i proteinskallen. Særligt fleksible konstruktionselementer fungerer her som hængsler, sikrer, at proteinet folder anderledes og fast omslutter og beskytter den integrerede cofaktor. Interaktionen mellem proteinmiljø og cofaktor er afgørende for at stabilisere cofaktoren i dens katalytiske form.
"Vi antager, at ikke kun [FeFe]-hydrogenaser opnår deres cofaktor på denne måde, men at mekanismen også forekommer i andre metalholdige enzymer, " siger Happe.
 Varme artikler
Varme artikler
-
 Forskere opdager, at traditionelle væskestrømobservationer kan gå glip af det store billedeEn tidsmæssig reaktion opstod under væskestrømmen indikerede en grundlæggende strukturændring i væskerne. Kredit:Figur tilpasset med tilladelse fra forsiden af J. Phys. Chem. B 2019, 123, 21, 4587-4
Forskere opdager, at traditionelle væskestrømobservationer kan gå glip af det store billedeEn tidsmæssig reaktion opstod under væskestrømmen indikerede en grundlæggende strukturændring i væskerne. Kredit:Figur tilpasset med tilladelse fra forsiden af J. Phys. Chem. B 2019, 123, 21, 4587-4 -
 Forskere opdager vejen til at forbedre spilskiftende batterielektrodeElbilproducenter er intenst interesserede i lithium-rige batterikatoder, der kan øge rækkevidden betydeligt. En ny undersøgelse åbner en vej til at få dem til at leve op til deres løfte. Kredit:Stanfo
Forskere opdager vejen til at forbedre spilskiftende batterielektrodeElbilproducenter er intenst interesserede i lithium-rige batterikatoder, der kan øge rækkevidden betydeligt. En ny undersøgelse åbner en vej til at få dem til at leve op til deres løfte. Kredit:Stanfo -
 Genbrug af plastik:Vinylpolymer nedbrudt til aspirinkomponenterDer går ikke en dag uden nyheder om mikroplastik i vores have. Der er ikke mange effektive metoder til genanvendelse af plast uden at gå på kompromis med kvaliteten. Et fyrtårn af håb blev for nylig t
Genbrug af plastik:Vinylpolymer nedbrudt til aspirinkomponenterDer går ikke en dag uden nyheder om mikroplastik i vores have. Der er ikke mange effektive metoder til genanvendelse af plast uden at gå på kompromis med kvaliteten. Et fyrtårn af håb blev for nylig t -
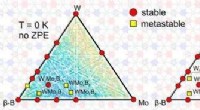 Forskere forudsiger nyt, hårdt, og superhårde ternære forbindelserTernær fasediagram over W-Mo-B-systemet ved 0 K. Kredit:A. Kvashnin et al./Chemistry of Materials Forskere fra Skolkovo Institute of Science and Technology (Skoltech), Institute of Solid State Che
Forskere forudsiger nyt, hårdt, og superhårde ternære forbindelserTernær fasediagram over W-Mo-B-systemet ved 0 K. Kredit:A. Kvashnin et al./Chemistry of Materials Forskere fra Skolkovo Institute of Science and Technology (Skoltech), Institute of Solid State Che
- Teknikfirmaer underskriver et løfte om at afstå fra at hjælpe cyberangreb
- Mars har de rigtige ingredienser til nutidens mikrobielle liv under sin overflade, undersøgelse fin…
- Statens politi i New York halter bagefter bureauer på landsplan for kamerabrug
- Ny metode til at bestemme molekylets chiralitet
- Fire økosystemer i Pennsylvania
- Verdens aldrende store dæmninger udgør en ny risiko:FN


