Designet protein switch tillader hidtil uset kontrol over levende celler
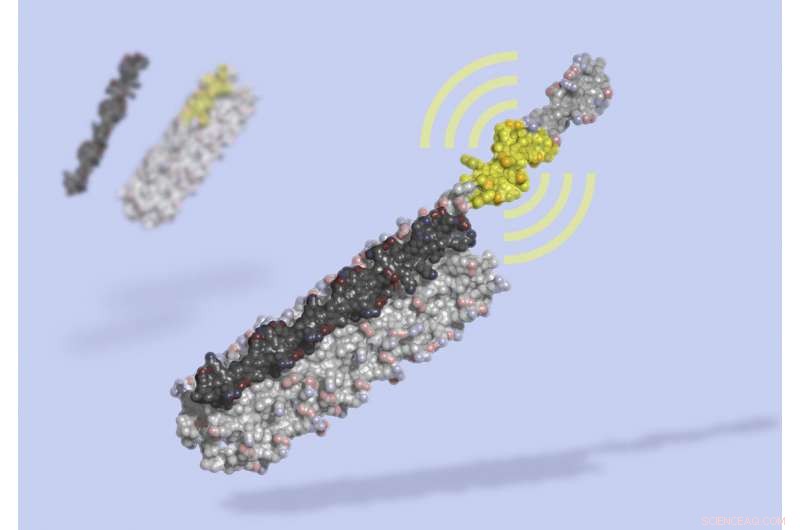
LOCKR er en molekylær kontakt lavet af flere interagerende dele:en 'nøgle' (sort) låser op for et 'bur' (grå), afsløre et bioaktivt peptid (gult), som kan interagere med andre molekyler i cellen. LÅS, et syntetisk proteinkompleks, blev beregnet designet fra bunden, derefter testet i levende celler. Kredit:Ian Haydon, UW Medicine Institute for Protein Design
Forskere har skabt den første fuldstændig kunstige proteinswitch, der kan arbejde inde i levende celler for at modificere - eller endda styre - cellens komplekse interne kredsløb.
Kontakten er døbt LOCKR, forkortelse for Latching, Ortogonalt bur/nøglepRotein.
Ledsagende papirer offentliggjort den 24. juli i tidsskriftet Natur beskrive LOCKRs design og demonstrere flere praktiske anvendelser af teknologien. Arbejdet blev udført af bioingeniørhold ledet af David Baker ved UW Medicine Institute for Protein Design og Hana El-Samad ved UC San Francisco.
Forskerne viser, at LOCKR kan "programmeres" til at modificere genekspression, omdirigere mobiltrafik, nedbryder specifikke proteiner, og kontrollere proteinbindingsinteraktioner. Forskerne bruger også LOCKR til at bygge nye biologiske kredsløb, der opfører sig som autonome sensorer. Disse kredsløb registrerer signaler fra cellens interne eller eksterne miljø og reagerer ved at foretage ændringer i cellen. Dette svarer til den måde, en termostat registrerer omgivelsestemperaturen på og dirigerer et varme- eller kølesystem til at lukke sig selv, så snart en ønsket temperatur er nået.
Når først de er samlet af en celle, disse nye kontakter måler kun otte nanometer på deres længste side. Mere end hundrede millioner ville være nødvendige for at dække perioden i slutningen af denne sætning.
"Evnen til at kontrollere celler med designerproteiner indleder en ny æra af biologi, sagde El-Samad, Kuo familieprofessor i biokemi og biofysik ved UCSF og co-senior forfatter af rapporterne. "På samme måde som integrerede kredsløb muliggjorde eksplosionen af computerchipindustrien, disse alsidige og dynamiske biologiske kontakter kunne snart frigøre præcis kontrol over levende cellers adfærd og, ultimativt, vores helbred."
Har ingen modstykke i den naturlige verden, LOCKR adskiller sig fra ethvert værktøj i biotekbranchen, herunder nyere teknologier som optogenetik og CRISPR. Mens dens forgængere blev opdaget i naturen og derefter ombygget til brug i laboratorier, industri, eller medicin, LOCKR er blandt de første bioteknologiske værktøjer, der udelukkende er udtænkt og bygget af mennesker.
Hovedforfatterne af rapporterne er Bobby Langan og Scott Boyken fra UW Medicine Institute for Protein Design, og Andrew Ng fra UC Berkeley-UCSF Graduate Program in Bioengineering.
"Lige nu, hver celle reagerer på sit miljø, " sagde Langan. "Celler modtager stimuli, så må man finde ud af hvad man skal gøre ved det. De bruger naturlige systemer til at justere genekspression eller nedbryde proteiner, for eksempel."
Langan og hans kolleger satte sig for at skabe en ny måde at interagere med disse cellulære systemer. De brugte beregningsproteindesign til at skabe selvsamlende proteiner, der kun præsenterer bioaktive peptider ved tilføjelse af specifikke molekylære "nøgler".
Med en version af LOCKR installeret i gær, holdet var i stand til at vise, at den gensplejsede svamp kunne bringes til at nedbryde et specifikt cellulært protein på et tidspunkt efter forskernes valg. Ved at omdesigne switchen, de viste også den samme effekt i laboratoriedyrkede humane celler.
At forblive sund, celler skal nøje kontrollere deres biokemiske processer. Unormal aktivitet i kun ét gen, eller opbygning af det forkerte protein, kan forstyrre en celles ligevægt. Dette kan føre til celledød eller endda kræft. LOCKR giver forskere en ny måde at interagere med levende celler på. Det kunne derved muliggøre en ny bølge af terapier til så forskellige sygdomme som kræft, autoimmune lidelser og meget mere.
"LOCKR åbner et helt nyt område af muligheder for programmering af celler, " sagde Ng. "Vi er nu mere begrænset af vores fantasi og kreativitet frem for de proteiner, som naturen har udviklet."
Sidste artikelHvordan naturen bygger brintproducerende enzymer
Næste artikelMaterialer til brintservice avanceret af nyt multilab-konsortium
 Varme artikler
Varme artikler
-
 Forskere opfinder håndholdt enhed til hurtig overvågning af drikkevandskvalitetenNTU -forskere udviklede en bærbar enhed, inspireret af menneskekroppens evne, at opdage spor af tungmetaller i drikkevand på bare fem minutter. L-R:Assoc Prof Yong Ken-Tye og hans ph.d.-studerende Ste
Forskere opfinder håndholdt enhed til hurtig overvågning af drikkevandskvalitetenNTU -forskere udviklede en bærbar enhed, inspireret af menneskekroppens evne, at opdage spor af tungmetaller i drikkevand på bare fem minutter. L-R:Assoc Prof Yong Ken-Tye og hans ph.d.-studerende Ste -
 Smart blæk tilføjer nye dimensioner til 3D-udskrivningEt eksempel fra forskningen viser, hvordan et 3D-printet objekt sammensat af hydrogel (G1) kan ændre størrelse efter udskrivning. Selvom dette eksempel tjener til at demonstrere resultatet, andre obje
Smart blæk tilføjer nye dimensioner til 3D-udskrivningEt eksempel fra forskningen viser, hvordan et 3D-printet objekt sammensat af hydrogel (G1) kan ændre størrelse efter udskrivning. Selvom dette eksempel tjener til at demonstrere resultatet, andre obje -
 Kemikere lærer at opdage phenoler i røget madprøver ved hjælp af vitamin B4Påvisning af phenoler i pølse ved hjælp af vitamin B4 Kredit:SPbU I dag, phenoler bruges til at producere medicin, maling, og billige møbler af spånplader eller MDF -paneler og også til forarbejdn
Kemikere lærer at opdage phenoler i røget madprøver ved hjælp af vitamin B4Påvisning af phenoler i pølse ved hjælp af vitamin B4 Kredit:SPbU I dag, phenoler bruges til at producere medicin, maling, og billige møbler af spånplader eller MDF -paneler og også til forarbejdn -
 Sådan bestemmes hvilken forbindelse der er mere syrligEn simpel lakmustest kan fortælle dig, om en forbindelse er sur, basisk (alkalisk) eller neutral. Det er lidt mere udfordrende at finde ud af, hvor sur en forbindelse er i forhold til en anden. Du
Sådan bestemmes hvilken forbindelse der er mere syrligEn simpel lakmustest kan fortælle dig, om en forbindelse er sur, basisk (alkalisk) eller neutral. Det er lidt mere udfordrende at finde ud af, hvor sur en forbindelse er i forhold til en anden. Du
- Taiwans kæmper med betelnøddeafhængighed
- Ingen tab:Forskere fylder grafen med lys
- Den voldsomme Ferguson -brand i Californien truer Mariposa - igen
- Tyskland åbner Opel-undersøgelse i dieselgate-skandale
- Hvordan påvirker bærbare computere miljøet?
- Undersøgelse afdækker, hvor store tørker i Greater Mekong udløser kuldioxidemissioner


