Molekylær sondekort forkert foldet proteometilstand i levende celler
Kredit:Wiley
Proteinernes foldningstilstand i levende celler afspejler ofte cellens generelle helbred. Australske forskere har udviklet en molekylær sonde, der registrerer proteometilstanden - hele proteinernes sæt - ved at måle polariteten af proteinmiljøet. Fluorescenssignalet fra sonden kvantificerer udfoldelse, og dets kamæleonlignende farveskift kortlægger de cellulære områder med forbedret fejlfoldning, siger undersøgelsen offentliggjort i tidsskriftet Angewandte Chemie .
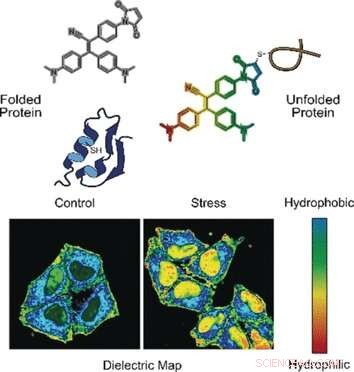
Hvis levende celler er stressede, proteinsyntese og foldningskorrektion er ude af balance. Fejlfoldede proteiner sidder fast, øget nedbrydning sker, og inaktive proteiner og proteinerester tilsluttes til dannelse af granuler og kondensater i cytoplasmaet. Sådanne aggregater spiller en vigtig rolle i neurodegenerative sygdomme og kræft. En drivende faktor for sammenlægningen af fejlfoldede proteiner synes at være polariteten - den elektroniske distribution i et miljø. Yuning Hong og kolleger ved La Trobe University Melbourne og The University of Melbourne, Australien, har designet en to-modal fluorogen probe til at overvåge proteinaggregation mere detaljeret.
I en tilstand, sonden registrerer fejlfoldede proteiner. Korrekt foldede proteiner stabiliseres ofte ved broer fremstillet af aminosyren cystein. Disse broer er normalt dybt begravet, der henviser til, at fejlfoldede proteiner udsætter cysteinresterne ved overfladen. Når sonden binder sig til cystein, der udsættes for en forkert foldet proteinkæde, fluorescens er tændt, forklare forfatterne.
I den anden tilstand, sonden vurderer polariteten. Polære miljøer angiver en ubalanceret elektronisk distribution, som kan måles med den dielektriske konstant. For at måle denne parameter, forskerne tilføjede en elektronisk "push -pull" kemisk gruppe til den fluorogene sonde. De observerede, at i polære løsninger med en høj dielektrisk konstant, den fluorogene sonde kaldet NTPAN-MI udsendte sit fluorescenssignal med et farveskift. Denne "kamæleon-lignende" farveændring indikerer således en polaritetsændring.
Forfatterne testede NTPAN-MI-sonden på en human cellelinje, som de understregede ved at tilføje lægemidler, der forstyrrede proteinsyntese og foldning. Forskerne observerede normal fluorescens i ubehandlede celler, men lys fluorescens når udfoldede eller fejlfoldede proteiner akkumuleres i celler behandlet med toksiner eller inficeret af virus. Ud over, farveskiftet signalerede polariteten i miljøet og dermed proteomtilstanden i hvert mobilrum. Forskerne rapporterede, at de visualiserede den "udfoldede proteinmængde" i kernen for første gang. Tidligere metoder kunne kun måle udfoldede proteiner i cytoplasmaet.
Med sine to sansemetoder-måling af udfoldelse og proteinmiljøets polaritet-giver NTPAN-MI-sonden et skarpere billede af stressreaktionerne fra levende celler end hvad der kan opnås med kun en-modale sonder eller forskellige metoder. Forfatterne påpeger, at deres metode ville give forskere mulighed for at opnå mere præcis viden om crosstalk af de cellulære komponenter som reaktion på stress.
 Varme artikler
Varme artikler
-
 Syre kan være nøgleingrediens for bedre klæbestyrke, elektroniske komponenterKredit:CC0 Public Domain En syre, der bruges til medicin og til at smage nogle drikkevarer snart, kan hjælpe med at gøre elektroniske komponenter og visse klæbemidler mere holdbare og bedre for mi
Syre kan være nøgleingrediens for bedre klæbestyrke, elektroniske komponenterKredit:CC0 Public Domain En syre, der bruges til medicin og til at smage nogle drikkevarer snart, kan hjælpe med at gøre elektroniske komponenter og visse klæbemidler mere holdbare og bedre for mi -
 Elektrolyse -gennembrud kunne løse brintproblemetKredit:Monash University Brintgas er det perfekte grønne brændstof - det kan udvindes fra vand og er ikke-forurenende. Men selvom brint er det mest udbredte grundstof i universet, det forekommer i
Elektrolyse -gennembrud kunne løse brintproblemetKredit:Monash University Brintgas er det perfekte grønne brændstof - det kan udvindes fra vand og er ikke-forurenende. Men selvom brint er det mest udbredte grundstof i universet, det forekommer i -
 Havsvampe bliver siddende med ankre, der bøjer, men ikke går i stykkerAnkerne, der holder Venus blomsterkurv havsvampe til havbunden, har en intern arkitektur, der øger deres evne til at bøje. Kredit:Kesari Lab/Brown University Havsvampe kendt som Venus blomsterkurv
Havsvampe bliver siddende med ankre, der bøjer, men ikke går i stykkerAnkerne, der holder Venus blomsterkurv havsvampe til havbunden, har en intern arkitektur, der øger deres evne til at bøje. Kredit:Kesari Lab/Brown University Havsvampe kendt som Venus blomsterkurv -
 Registrering af giftig PFAS med en sensor i chipstørrelseEn illustration af PNNLs PFAS -sensor. Vandprøver strømmer i den ene ende, gennem labyrinten, og PFOS bliver fanget af et svampelignende materiale i midten. Teknologien er tilgængelig for licensudsted
Registrering af giftig PFAS med en sensor i chipstørrelseEn illustration af PNNLs PFAS -sensor. Vandprøver strømmer i den ene ende, gennem labyrinten, og PFOS bliver fanget af et svampelignende materiale i midten. Teknologien er tilgængelig for licensudsted
- Unplugged-ferier tippede til at stige
- NASA analyserer den tropiske storm Wukongs jordbærform
- Data viser, hvordan amerikanske mødre balancerer arbejde og familie
- Afslører virkningen af 70 års brug af pesticider på europæisk jord
- Arktis brænder på en helt ny måde
- Uran skal erstatte plastik? Kemiens gennembrud kan bane vejen for nye materialer


