Enkel N-terminal modifikation af proteiner i et enkelt trin
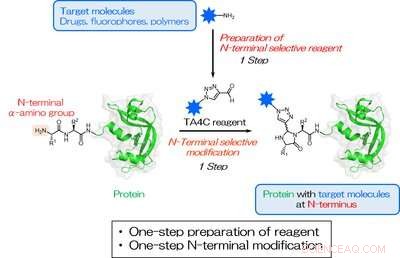
Fig. 1. Et et-trins præparat af TA4C og en et-trins biokonjugering målrettet mod en N-terminal a-aminogruppe. Den blå stjerne repræsenterer et målmolekyle for N-terminal modifikation. Kredit:Osaka University
Proteiner bruges meget i medicin, biologi og kemi. Forbedring af deres iboende egenskaber ved at tilføje funktionelle molekyler til deres strukturer er et fælles og vigtigt trin på mange områder. For eksempel, tilføjelse af fluorescerende molekyler gør det muligt at spore og kvantificere proteiner. Mange modifikationsstrategier med forskellige fordele er blevet beskrevet. Osaka Universitets forskere rapporterer nu om en simpel N-endespecifik modifikation udført under milde forhold ved hjælp af nye reagenser fremstillet i et trin. Deres resultater blev offentliggjort online i ChemBioChem .
N -enden er defineret som begyndelsen på proteinkæden, hvor aminogruppen i den første aminosyre byggesten er tilgængelig for at reagere. Specielt målrettet mod N -enden er nyttig, da den sjældent er involveret i proteinfoldningen, gør det let tilgængeligt, mens det har minimal indvirkning på proteinfunktionen. Det vides at være et unikt og altid nærværende sted inden for hvert protein.
Inspireret af tidligere værker, forskerne screenede en række cykliske nitrogenholdige forbindelser og fandt ud af, at 1H-1, 2, 3-triazol-4-carbaldehyd (TA4C) derivater kan konjugeres til N-terminalen i et enkelt trin med relativt høje omdannelser, op til 92%.
"Forenkling af proteinmodificering er en værdifuld udvikling på en række områder, "forklarer den tilsvarende forfatter Akira Onoda." Vores tilgang resulterer i yderst effektiv stedsspecifik mærkning under milde forhold, hvilket er vigtigt, når man arbejder med følsomme biologiske molekyler. Så længe molekylet, der skal tilføjes, indeholder en aminogruppe, en reaktion kan udføres for at oprette TA4C -gruppen i et trin, som derefter er reaktiv mod protein N -enden. "
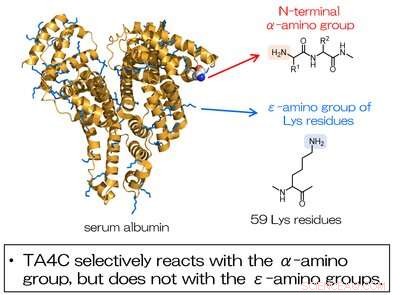
Fig. 2. Modifikationen af serumalbumin ved anvendelse af TA4C forløber selektivt ved den N-terminale a-aminogruppe og ikke ved aminogrupperne af Lys-rester. Kredit:Osaka University
TA4C -reagenserne fremstilles i et enkelt trin fra et funktionelt molekyle med en aminogruppe via en reaktion kendt som Dimroth -omlejringen. En række aminholdige molekyler blev anvendt med succes, herunder polyethylenglycol, biotin, og fluorescein, demonstrerer den brede vifte af mulige funktionaliteter.
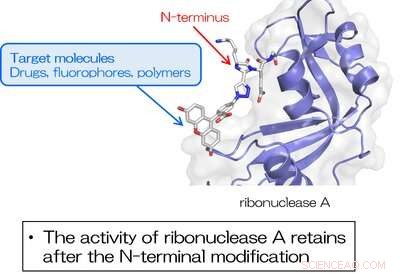
3. RNase A modificeret ved N-terminalen ved anvendelse af TA4C bevarer den iboende enzymaktivitet. Kredit:Osaka University
"Vi mener, at vores tilgang vil bidrage som en yderst praktisk mulighed for værktøjskassen til proteinmodificering og fremskynde udviklingen på mange områder, der er afhængige af proteinkonjugering, "forklarer den tilsvarende forfatter Takashi Hayashi." Desuden at kombinere vores tilgang med teknikker, der er målrettet mod andre proteinsider, vil tillade flere funktioner at blive introduceret, giver stor fleksibilitet. Dette vil vise sig gavnligt på en lang række områder, herunder bioingeniør, lægemidler, og diagnostik. "
 Varme artikler
Varme artikler
-
 Lysere fleksibel elektroluminescerende film ved at adoptere øjenstruktur fra natlige dyrStruktur og karakteristika af elektroluminescerende anordning ved hjælp af rekursiv reflektionsstruktur. Strukturer (a~e) og betragtningsvinkelkarakteristika (f) af en elektroluminescerende enhed, der
Lysere fleksibel elektroluminescerende film ved at adoptere øjenstruktur fra natlige dyrStruktur og karakteristika af elektroluminescerende anordning ved hjælp af rekursiv reflektionsstruktur. Strukturer (a~e) og betragtningsvinkelkarakteristika (f) af en elektroluminescerende enhed, der -
 Ny opdagelse af plutonium viser vejen til at rense atomaffaldThomas Albrecht-Schmitt er Gregory R. Choppin professor i kemi ved Florida State University. Kredit:Bill Lax/Florida State University Plutonium har længe været en del af mange landes atomenergistr
Ny opdagelse af plutonium viser vejen til at rense atomaffaldThomas Albrecht-Schmitt er Gregory R. Choppin professor i kemi ved Florida State University. Kredit:Bill Lax/Florida State University Plutonium har længe været en del af mange landes atomenergistr -
 Gips, der sidder inde i munden, kan forbedre behandlingen af orale tilstandeDet bionedbrydelige plaster sidder inde i munden og hjælper med at fremskynde behandlingen af smertefulde sår Kredit:University of Sheffield Et gips, der klæber til indersiden af din mund, rev
Gips, der sidder inde i munden, kan forbedre behandlingen af orale tilstandeDet bionedbrydelige plaster sidder inde i munden og hjælper med at fremskynde behandlingen af smertefulde sår Kredit:University of Sheffield Et gips, der klæber til indersiden af din mund, rev -
 Ny katalysator imødekommer udfordringen med at rense udstødningen fra moderne motorerForskere ved WSU, PNNL og University of New Mexico har udviklet en bedre katalysator til katalysatorer, der ændrer køretøjsforurenende stoffer til relativt godartede former for nitrogen, kuldioxid og
Ny katalysator imødekommer udfordringen med at rense udstødningen fra moderne motorerForskere ved WSU, PNNL og University of New Mexico har udviklet en bedre katalysator til katalysatorer, der ændrer køretøjsforurenende stoffer til relativt godartede former for nitrogen, kuldioxid og
- ATLAS-eksperiment undersøger kvark-gluonplasma i en ny undersøgelse af fotoproducerede muonpar
- Total udslettelse for supermassive stjerner
- 3D-printede modeller giver en klarere forståelse af jordens bevægelse
- Standing Wave: definition, formel og eksempler
- Undersøgelse bekræfter, at der ønskes mere mediedækning af klimaændringer
- En interaktiv drone til at hjælpe mennesker i kontormiljøer


