Nanopore afslører formskiftende enzym forbundet med katalyse
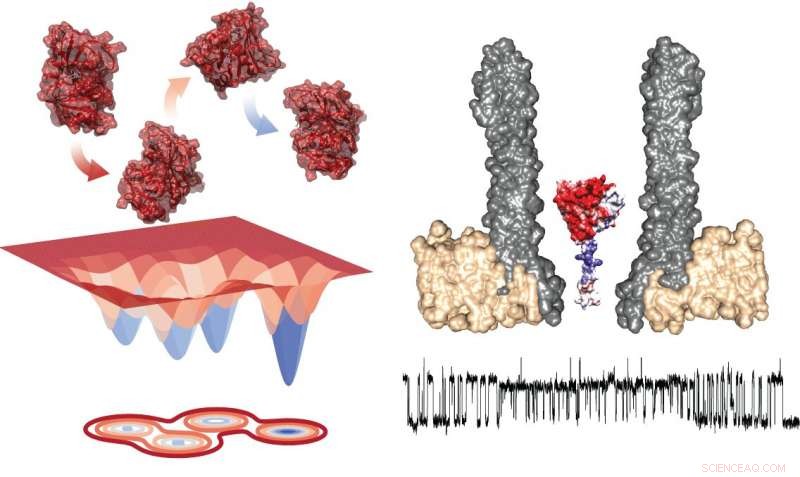
Energidiagram over de fire konformere (til venstre) og den eksperimentelle opsætning, der viser nanoporen med det fangede enzym i tværsnit (højre). Under, der er et typisk spor, der viser målinger under udveksling inden for rotamerer. Kredit:Giovanni Maglia, University of Groningen
University of Groningen forskere har observeret egenskaberne ved et enkelt enzym inde i en nanopore. De lærte, at enzymet kan eksistere i fire forskellige foldede tilstande, eller konformere, der spiller en aktiv rolle i reaktionsmekanismen. Disse resultater vil have konsekvenser for enzymteknik og udvikling af inhibitorer. Undersøgelsen blev offentliggjort i Naturkemi den 6. april.
Enzymer er foldede proteiner, der har en specifik tredimensionel struktur, der skaber et aktivt sted, der kan binde et substrat og katalysere en specifik reaktion. I de seneste år, det er blevet klart, at enzymer ikke er stive strukturer, men at de foldede proteiner eksisterer som et ensemble af konformationer i ligevægt omkring en energisk stabil grundtilstand.
Vindtunnel
At studere overgangen mellem stater kræver observation af enkelte enzymer i en længere periode, hvilket er udfordrende. University of Groningen Lektor i kemisk biologi Giovanni Maglia udviklede tragtformede nanoporer, der kan fange proteiner. Ved at måle ionstrømmen over en sådan nanopore indlejret i en kunstig lipidmembran, Maglia var i stand til at observere konformationsændringer i enzymer. "Du kan sammenligne det med at studere en bil i en vindtunnel, "forklarer han." Åbning af et vindue eller en dør ændrer luftstrømmen. På lignende måde, en ændring i enzymets foldestruktur ændrer ionstrømmen gennem poren. "
Maglia brugte sit nanoporesystem til at undersøge enzymet dihydrofolatreduktase (DHFR), som omdanner dihydrofolat til tetrahydrofolat. "Vi valgte dette enzym, fordi det er blevet undersøgt som et modelsystem for enzymdynamik i over 30 år, ved hjælp af alle tilgængelige teknikker. Ud over, hæmmere af dette enzym, såsom methotrexat, bruges som kræftbekæmpende medicin.
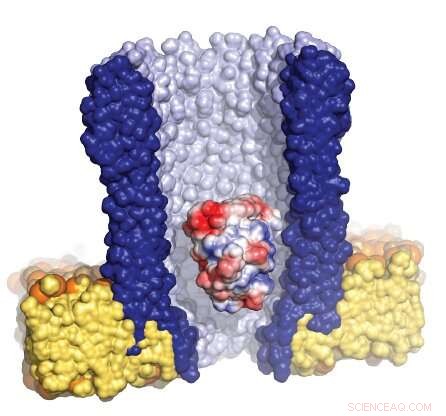
Illustration af den tragtformede nanopore (blå) omgivet af den kunstige membran (gul), med et enkelt enzym (rød/hvid/blå) fanget inde i poren. Kredit:Giovanni Maglia, University of Groningen
Effektiv frigivelse
Målinger af DHFR afslørede tilstedeværelsen af fire konformere med forskellige affiniteter for substraterne. Maglia siger, "Skiftet mellem disse fire tilstande var meget langsomt. Det betyder, at du kun kan se dem i den slags langvarige enkeltenzymundersøgelser."
Tilsætning af reaktionshæmmer methotrexat, som binder sig til enzymet, forårsagede en meget hurtig overgang mellem tilstande og ændrede enzymers affinitet. "Vores konklusion er, at enzymets reaktioner med forskellige forbindelser giver den frie energi til konformationsændringer, ”siger Maglia.
Desuden, konformationsændring ændrede også enzymernes affinitet. Dette giver mening, da enzymet skal binde to substrater og, efter afslutning af reaktionen, skal frigive begge. "Substratet og produktet er meget ens molekyler, så enzymet skal ændre sin affinitet for en effektiv frigivelse. "
To stater
Baseret på disse undersøgelser, Maglia kan se enzymet skifte mellem to tilstande:Efter binding af substratet, NADPH driver reaktionen, som derefter ændrer enzymets konformation og derved dets affinitet. Efterfølgende, binding af et nyt substrat bringer det tilbage til den første tilstand. "Dette forklarer to af de fire konformere, som vi observerede; vi kan endnu ikke give mening om de to andre, "Siger Maglia. Det er umuligt at udlede strukturelle oplysninger fra målingerne.
Alligevel, undersøgelsen viser kraften i nanopore -teknologi til at bestemme de strukturelle ændringer af enzymer. "Vi ved også nu, at dette enzym har fire forskellige jordtilstande og skal skifte mellem dem for at fungere." Dette tilføjer en udfordring til enzymdesign:Ikke alene bør dette producere et reaktivt center, men det bør også tillade de nødvendige konformationsændringer. Maglia:"Dette kan forklare, hvorfor kunstigt designede enzymer ofte ikke fungerer så effektivt som naturlige enzymer." Endelig, undersøgelsen vil også give forskere mulighed for at identificere nye hæmmende lægemidler, der binder tættere til DHFR end methotrexat.
 Varme artikler
Varme artikler
-
 Fjernelse af globalt brugt angstmedicin fra spildevand til lave omkostningerDet globalt anvendte angstpræparat Diazepam kan nu fjernes fra genbrugsvand og spildevand, ved hjælp af billige titaniumdioxid nanofibre, siger prof Vinod Gupta fra University of Johannesburg. Først m
Fjernelse af globalt brugt angstmedicin fra spildevand til lave omkostningerDet globalt anvendte angstpræparat Diazepam kan nu fjernes fra genbrugsvand og spildevand, ved hjælp af billige titaniumdioxid nanofibre, siger prof Vinod Gupta fra University of Johannesburg. Først m -
 Uforgængelig virus giver hemmelighed ved at skabe utroligt holdbare materialerPeter M. Kasson, M.D., Ph.d., (til venstre) og Edward H. Egelman, Ph.d., har låst op for hemmelighederne ved en næsten uforgængelig virus, muligvis tillader forskere at udnytte sine bemærkelsesværdige
Uforgængelig virus giver hemmelighed ved at skabe utroligt holdbare materialerPeter M. Kasson, M.D., Ph.d., (til venstre) og Edward H. Egelman, Ph.d., har låst op for hemmelighederne ved en næsten uforgængelig virus, muligvis tillader forskere at udnytte sine bemærkelsesværdige -
 At bytte vand til CO2 kan gøre fracking grønnere og mere effektivtEn skiferprøve klar til brud med CO2. Kredit:Xuehang Song Forskere ved det kinesiske videnskabsakademi og China University of Petroleum (Beijing) har påvist, at CO 2 kan give en bedre hydraulisk
At bytte vand til CO2 kan gøre fracking grønnere og mere effektivtEn skiferprøve klar til brud med CO2. Kredit:Xuehang Song Forskere ved det kinesiske videnskabsakademi og China University of Petroleum (Beijing) har påvist, at CO 2 kan give en bedre hydraulisk -
 Ny metal-organisk ramme kan optage giftig svovldioxidgasIllustration af svovldioxid fanget i MFM-170-materialet, som afsløret af eksperimenter ved Berkeley Labs Advanced Light Source. Kredit:Gemma Smith/Manchester University Et internationalt team har
Ny metal-organisk ramme kan optage giftig svovldioxidgasIllustration af svovldioxid fanget i MFM-170-materialet, som afsløret af eksperimenter ved Berkeley Labs Advanced Light Source. Kredit:Gemma Smith/Manchester University Et internationalt team har
- Bradford Co. vandkvaliteten forbedres; påvirker sjældne i nærheden af skifergasbrønde
- Tilbageværende og efterladte mere forenede end splittede, undersøgelse finder
- Efterligning af naturens bedste medicin åbner døren til nye behandlinger
- Sådan læses Gel Electrophoresis
- Kunstig intelligens kaster lys over membranydelsen
- Efter gadebelysning i et helt amt blev skiftet til lysdioder, lysforureningen blev værre


