Små molekylære bevægelser kan føre til mere effektive biobrændselsceller
Kredit:Leiden Universitet
Leiden-forskere har fundet små bevægelser i laccase-enzymet. Denne opdagelse kan føre til udviklingen af meget mere effektive biobrændselsceller. Udgivelse i Biofysisk tidsskrift .
Laccaseproteinenzymet er en meget effektiv katalysator, hvilket gør det interessant til brug i biobrændselsceller. Laccase-enzymet er i stand til effektivt at skabe vand fra ilt uden at skabe hydrogenperoxid, en ustabil forbindelse, der ville skade biobrændselsceller. Fordi proteiner har en tendens til at være ustabile, forskere har forsøgt at genskabe laccases egenskaber i mere holdbare uorganiske forbindelser.
Mens disse nye uorganiske forbindelser er mere robuste end de originale proteiner, de er ikke så effektive. En ny opdagelse fra Leiden-kemikere åbner nye muligheder for at forbedre de uorganiske replikaer.
Indtil nu, videnskabsmænd anså laccaser for at være ret stive og har lavet uorganiske replikaer til at være tilsvarende faste. Kemiker Rubin Dasgupta og andre ved Leiden Institute of Chemistry (LIC) har opdaget små bevægelser inde i proteinet, som kan bidrage til laccases effektivitet.
Mikrosekunder
Disse små bevægelser sker på enzymets såkaldte aktive sted, det nøjagtige punkt på proteinet, hvor kemiske reaktioner finder sted. Rubin Dasgupta forklarer, hvordan han opdagede de små bevægelser:"Vi brugte kernemagnetisk resonansspektroskopi til at se på det aktive sted for laccaseproteinet. Vi opdagede, at laccase bevæger sig en smule. Disse bevægelser tager kun millisekunder, hvilket tyder på, at de kunne være involveret i reaktion."
Ifølge Dasgupta, denne dynamik kan være ansvarlig for at lede protoner og elektroner til det rigtige sted under en kemisk reaktion. Fordi de uorganiske replikaer er designet til at være stive, de mangler mulighed for at lede partikler på samme måde. Dette kan delvist forklare deres lavere effektivitet sammenlignet med naturlig laccase.
Bakterielt protein
Laccaser blev først opdaget i det nittende århundrede, men det specifikke protein Dasgupta-undersøgelser blev opdaget i 2004. Mens de fleste undersøgte laccaser kommer fra svampe, netop dette enzym kom fra bakterien Streptomyces coelicolor.
Dasgupta:"Vi valgte netop dette protein, fordi det har nogle få fordele i forhold til svampe-laccaser. Normale laccaser bliver inaktive i nærværelse af salt eller høj alkalinitet. Dette Streptomyces-protein forbliver aktivt under salt eller alkaliske forhold. Hvis vi er i stand til at skabe en uorganisk replika, der efterligner både de små bevægelser og er modstandsdygtig over for høj pH, det vil være muligt at designe et helt nyt udvalg af effektive biobrændselsceller."
 Varme artikler
Varme artikler
-
 Hvorfor bruges magnesiumklorid i PCR?Når en efterforsker eller en læge får en DNA-prøve, er der ofte ikke nok DNA til rådighed til korrekt analyse. For at simulere kroppens egen DNA-replikationsproces udviklede forskere en proces kald
Hvorfor bruges magnesiumklorid i PCR?Når en efterforsker eller en læge får en DNA-prøve, er der ofte ikke nok DNA til rådighed til korrekt analyse. For at simulere kroppens egen DNA-replikationsproces udviklede forskere en proces kald -
 Forskere kommer op med nanobeton til støbning under negative temperaturforholdEt nærbillede af kæmpe stilladser på byggepladsen til bygning af det nye Kommunebibliotek. Til venstre er de tykke lag af stilladser nødvendige for at understøtte den forreste vandrette frontfacade. K
Forskere kommer op med nanobeton til støbning under negative temperaturforholdEt nærbillede af kæmpe stilladser på byggepladsen til bygning af det nye Kommunebibliotek. Til venstre er de tykke lag af stilladser nødvendige for at understøtte den forreste vandrette frontfacade. K -
 SARS-CoV-2 i spildevandsfaststoffer kan hjælpe med at overvåge spredningen af COVID-19City of San José Environmental Services Departments miljøinspektører Isaac Tam og Laila Mufty installerer en autosampler i et mandehul ved San José - Santa Clara regionale spildevandsanlæg. Kredit:Cit
SARS-CoV-2 i spildevandsfaststoffer kan hjælpe med at overvåge spredningen af COVID-19City of San José Environmental Services Departments miljøinspektører Isaac Tam og Laila Mufty installerer en autosampler i et mandehul ved San José - Santa Clara regionale spildevandsanlæg. Kredit:Cit -
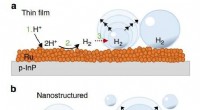 Gør solbrintgenerering mere effektiv i mikrogravitationTværsnitsillustration af en gasboble-evolutionsmodel på den tynde film og nanostrukturerede fotoelektrode. Hvorimod H2 dannes ved diskretionære nukleationspletter på tyndfilmselektrodeoverfladen (a),
Gør solbrintgenerering mere effektiv i mikrogravitationTværsnitsillustration af en gasboble-evolutionsmodel på den tynde film og nanostrukturerede fotoelektrode. Hvorimod H2 dannes ved diskretionære nukleationspletter på tyndfilmselektrodeoverfladen (a),


