Målretning af SARS-CoV-2-enzym med inhibitorer
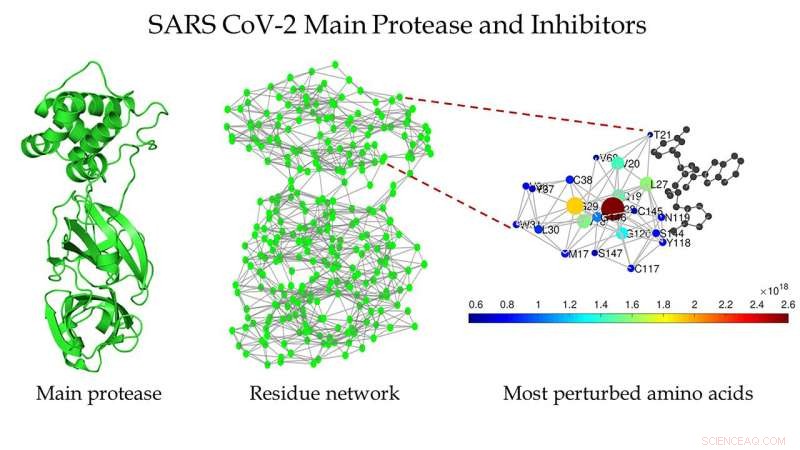
Skematisk af hovedproteasen af SARS CoV-2 (venstre), proteinrestnetværket af hovedproteasen i SARS CoV-2 (i midten), og en zoomet visning af området omkring bindingsstedet som detekteret af Estrada (til højre). Kredit:Ernesto Estrada
Da COVID-19-pandemien forårsaget af coronavirus SARS-CoV-2 fortsætter med at sprede sig over hele verden, mange forskere studerer epidemiologiske modeller for at forudsige dens udbredelse.
Imidlertid, Ernesto Estrada, en matematiker og ekspert i komplekse systemer af ARAID Foundation ved University of Zaragoza, besluttede at fokusere på at finde mål inden for SARS-CoV-2 for nye lægemidler at angribe. Fra tidligere arbejde, han vidste, at virussens hovedprotease, et enzym, der er ansvarlig for proteolytisk behandling af polyproteiner, er et fremragende mål.
I journalen Kaos , Estrada sagde, da han og kolleger opdagede en dramatisk stigning i følsomheden af SARS-CoV-2's vigtigste protease over for små forstyrrelser, det fik dem til at mistænke, at der er en rolle for inhibitorer at spille i at dræbe virussen.
Inhibitorer er organiske molekyler, stoffer, eller nye kemiske forbindelser, der binder sig til en proteases bindingssted for at hæmme dens arbejde. En virus vil dø uden at et proteolytisk enzym virker for det.
"Jeg lagde mærke til, at kemikere allerede havde fundet nogle potente hæmmere af SARS-CoV-2's hovedprotease, og at de havde løst strukturen af dette protein via røntgenkrystallografi, " sagde han. "Det var chokerende at se, at denne protease ligner meget SARS-coronavirus, som forårsagede epidemierne i 2003, SARS-CoV-1."
Da forskere lagde begge strukturer oven på hinanden, de matchede næsten perfekt.
"Hvis du opretter aminosyresekvenserne for begge proteaser, der er kun 12 ud af 306 rester, der ikke er sammenfaldende, " sagde Estrada. "Er der noget skjult bag disse tilsyneladende ligheder mellem de to proteaser? Kan vi lære noget af dem for at forbedre designet af lægemidler mod virussen?"
Estradas gruppe har stor erfaring med analyse af netværk – som sociale netværk, internettet, eller fødekæder mellem arter i et miljø - og besluttede at behandle et protein som netværk.
"De kaldes proteinrestnetværk, hvor vi repræsenterer hver aminosyre som en knude, og interaktionen mellem to aminosyrer er repræsenteret ved en forbindelse mellem de to, " forklarede han.
De fandt flere strukturer af hovedproteasen af SARS CoV-1 og SARS CoV-2, der var rene, hvilket betyder, at de ikke indeholder nogen mutationer, ligander, eller opløsningsmidler i deres strukturer. De transformerede deres struktur til proteinrestnetværk.
Estrada sagde, at de fleste traditionelle netværksforanstaltninger afslørede, at begge strukturer var meget lig hinanden, noget hans team allerede vidste. "Men for et par år siden, vi udviklede en mere sofistikeret matematisk målestok, der giver os mulighed for at opdage, hvor langt væk en forstyrrelse i et netværk kan spredes. Det arbejde var meget teoretisk, matematisk natur, men vi havde spekuleret i, at det kunne være nyttigt til studiet af proteiner."
Så de satte det på prøve. Det afslørede, at proteasen af SARS-CoV-2 er 1, 900 % mere følsom over for langdistancetransmission af forstyrrelser end proteasen fra SARS-CoV-1.
"Det betyder, at når et protein forstyrres, for eksempel ved vand i det intracellulære miljø, sådanne forstyrrelser overføres gennem et netværk af intrarester, der danner 3D-strukturen af proteinet, " sagde Estrada. "Hvis en sådan forstyrrelse produceres omkring en given aminosyre i proteasen af SARS-CoV-1, det overføres kun gennem et tæt miljø omkring den forstyrrede aminosyre."
Men hvis denne forstyrrelse opstår til en aminosyre i proteasen af SARS-CoV-2, det overføres til næsten hele netværket - selv til aminosyrer meget langt væk.
"Det er bemærkelsesværdigt, fordi det betyder, at med små strukturelle forskelle er proteasen af SARS-CoV-2 meget mere effektiv inden for intrarestkommunikation, " sagde Estrada. "Det burde være meget mere effektivt til at udføre sit arbejde som et proteolytisk enzym af virussen. Djævelen gjorde et næsten perfekt stykke arbejde her, men han lod døren stå åben. Denne store følsomhed af SARS-CoV-2-proteasen over for forstyrrelser kan være dens akilleshæl i forhold til inhibitorer."
Gruppens tilgang kan bruges til massive screeningsprotokoller til at identificere potente inhibitorer af SARS-CoV-2 hovedprotease og, følgelig, for udvikling af nye lægemidler til at dræbe det.
 Varme artikler
Varme artikler
-
 Vurdering af den luftbårne overlevelse af bakterier i aerosoldråber fra hoste og nysVed at bruge den nye tilgang, skyer af aerosoldråber (f.eks. 40 vist på billedet) kan fanges og manipuleres, muliggør en simulering af deres miljøeksponering Kredit:University of Bristol Den luftb
Vurdering af den luftbårne overlevelse af bakterier i aerosoldråber fra hoste og nysVed at bruge den nye tilgang, skyer af aerosoldråber (f.eks. 40 vist på billedet) kan fanges og manipuleres, muliggør en simulering af deres miljøeksponering Kredit:University of Bristol Den luftb -
 Ny fotokatalysator omdanner effektivt kuldioxid til metanbrændstof med lysDr. Ng og hans team syntetiserede en ny fotokatalysator ved at indpakke kobberoxid med kobberbaserede metal-organiske rammer. Kredit:City University of Hong Kong Kuldioxid (CO 2 ) er en af de
Ny fotokatalysator omdanner effektivt kuldioxid til metanbrændstof med lysDr. Ng og hans team syntetiserede en ny fotokatalysator ved at indpakke kobberoxid med kobberbaserede metal-organiske rammer. Kredit:City University of Hong Kong Kuldioxid (CO 2 ) er en af de -
 Kemisk datamining øger søgen efter nye organiske halvledereBåde de kulstofbaserede molekylære rammer og de funktionelle grupper har afgørende indflydelse på ledningsevnen af organiske halvledere. Forskere ved det tekniske universitet i München (TUM) anvende
Kemisk datamining øger søgen efter nye organiske halvledereBåde de kulstofbaserede molekylære rammer og de funktionelle grupper har afgørende indflydelse på ledningsevnen af organiske halvledere. Forskere ved det tekniske universitet i München (TUM) anvende -
 Simuleringer identificerer betydningen af gitterforvrængninger i ionledende brændselscellemateri…Illustrationerne viser, hvordan sammenhængen mellem gitterforvrængning og protonbindingsenergi i et materiale påvirker protonledning i forskellige miljøer. At formindske denne interaktion kan hjælpe f
Simuleringer identificerer betydningen af gitterforvrængninger i ionledende brændselscellemateri…Illustrationerne viser, hvordan sammenhængen mellem gitterforvrængning og protonbindingsenergi i et materiale påvirker protonledning i forskellige miljøer. At formindske denne interaktion kan hjælpe f
- Tør sommer 2018:En tiendedel af de centraleuropæiske skove mistede blade for tidligt
- Mursten for mursten, en løsning, der søger at vælte vejspærringen for energilagring
- Forudsiger tidligt forårsknald med genetik mod klimaændringer
- Bioplast i bæredygtighedsdilemmaet
- Hvad skete der med de hypede nanomaterialer?
- Ny målemetode muliggør mere præcis undersøgelse af ultrahurtige processer i stof


