Røntgenstråler gør proteinstrukturen større i hjertet af COVID-19-virus
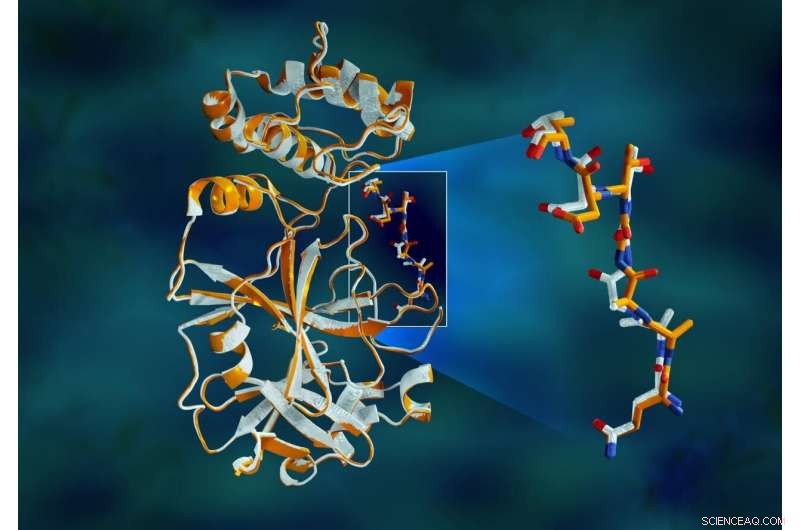
Overlappende røntgendata for SARS-CoV-2-hovedproteasen viser strukturelle forskelle mellem proteinet ved stuetemperatur (orange) og den kryogenfrosne struktur (hvid). Kredit:Jill Hemman/ORNL, US Department of Energy
Et team af forskere ved Department of Energy's Oak Ridge og Argonne nationale laboratorier har udført de første rumtemperatur røntgenmålinger på SARS-CoV-2 hovedproteasen - enzymet, der gør det muligt for virussen at reproducere.
Røntgenmålingerne markerer et vigtigt første skridt i forskernes ultimative mål om at bygge en omfattende 3-D-model af det enzymatiske protein. Modellen vil blive brugt til at fremme supercomputing-simuleringer med det formål at finde lægemiddelhæmmere til at blokere virussens replikationsmekanisme og hjælpe med at afslutte COVID-19-pandemien. Deres forskningsresultater er offentligt tilgængelige og er blevet offentliggjort i tidsskriftet Naturkommunikation .
SARS-CoV-2 er den virus, der forårsager sygdommen COVID-19. Virusset formerer sig ved at udtrykke lange kæder af proteiner, som skal skæres i mindre længder af proteaseenzymet.
"Proteasen er uundværlig for virusets livscyklus. Proteinet er formet som et valentins hjerte, men det er virkelig virussens hjerte, der tillader den at replikere og sprede sig. Hvis du hæmmer proteasen og stopper hjertet, virussen kan ikke producere de proteiner, der er afgørende for dens replikation. Det er derfor, proteasen betragtes som et så vigtigt lægemiddelmål, " sagde ORNLs Andrey Kovalevsky, Kontaktforfatter. Mens strukturen er kendt fra kryogenisk konserverede krystaller, "Dette er første gang, strukturen af dette enzym er blevet målt ved stuetemperatur, hvilket er vigtigt, fordi det er tæt på den fysiologiske temperatur, hvor cellerne opererer."
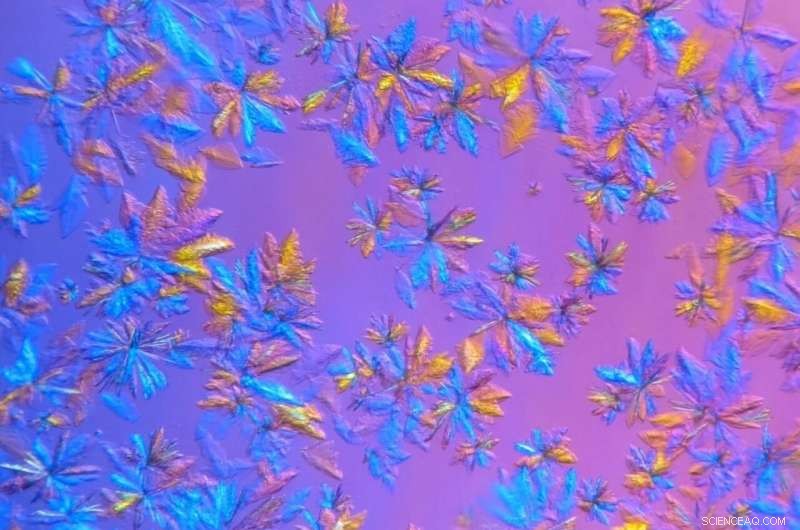
SARS-CoV-2 proteasekrystaller, dyrket i ORNLs proteinkrystallisations- og karakteriseringslaboratorium og afbildet i mikroskopisk visning, vil blive brugt i røntgenspredningsforsøg. Kredit:Daniel Kneller/ORNL, US Department of Energy
Opbygning af en komplet model af proteinstrukturen kræver identifikation af hvert element i strukturen, og hvordan de er arrangeret. Røntgenstråler er ideelle til at detektere tunge grundstoffer såsom kulstof, nitrogen- og oxygenatomer. På grund af intensiteten af røntgenstrålerne på de fleste store synkrotronfaciliteter, biologiske prøver skal typisk fryses kryogent til omkring 100 K, eller cirka minus 280 grader Fahrenheit, at modstå strålingen længe nok til, at data kan indsamles.
For at forlænge levetiden af de krystalliserede proteinprøver og måle dem ved stuetemperatur, ORNL-forskere voksede krystaller større end nødvendigt til synkrotron-kryo-studier og brugte en intern røntgenmaskine, der har en mindre intens stråle.
"At dyrke proteinkrystaller og indsamle data er en kedelig og tidskrævende proces. I den tid det typisk tager at forberede og sende prøven til en synkrotron, vi var i stand til at dyrke krystallerne, tage målingerne og begynde at analysere dataene, "sagde ORNLs Daniel Kneller, undersøgelsens første forfatter. "Og, når der er en pandemi med mange forskere, der mobiliserer for at studere dette problem, der er ikke en dag til overs."
Proteaseenzymet består af kæder af aminosyrer med et gentaget mønster af nitrogen-kulstof-kulstof-atomer, der danner rygraden i proteinet. Sidegrupper af aminosyrebyggestenene, eller "rester, " strækker sig fra hvert af de centrale carbonatomer i rygraden. Enzymet er foldet til en specifik 3-D form, skabe specielle lommer, hvor et lægemiddelmolekyle ville fæstne sig.
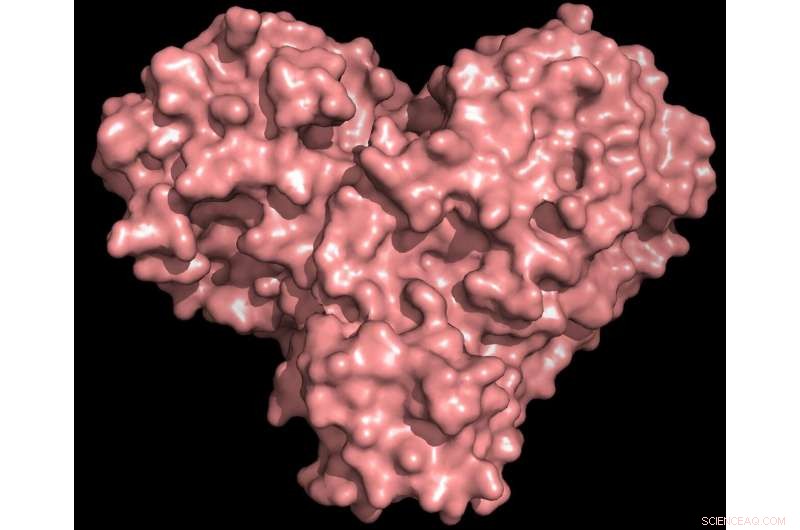
Proteaseproteinet er både formet som et hjerte og fungerer som et, tillader virussen at replikere og sprede sig. Inhibering af proteasen ville blokere virusreproduktion. Kredit:Kredit:Andrey Kovalevsky/ORNL, US Department of Energy
Undersøgelsen afslørede betydelige strukturelle forskelle mellem orienteringerne af rygraden og nogle af resterne i stuetemperatur- og kryogene prøver. Forskningen tyder på, at frysning af krystallerne kan introducere strukturelle artefakter, der kan resultere i en mindre nøjagtig forståelse af proteasestrukturen.
Teamets resultater deles med forskere, ledet af ORNL-University of Tennessee guvernørformand Jeremy Smith, som udfører drug docking-simuleringer ved hjælp af Summit at ORNL - landets hurtigste supercomputer.
"Det, forskerne laver på Summit, er at tage kendte lægemiddelforbindelser og forsøge at binde dem til den primære protease til genbrug af lægemidler, såvel som på udkig efter nye kundeemner til andre potentielle lægemiddelkandidater, " sagde ORNL tilsvarende forfatter Leighton Coates. "Vores rumtemperaturdata bliver brugt til at bygge en mere nøjagtig model for disse simuleringer og forbedre lægemiddeldesignaktiviteter."
Forskernes næste skridt i færdiggørelsen af 3-D-modellen af SARS-CoV-2 hovedproteasen er at bruge neutronspredning ved ORNL's High Flux Isotope Reactor og Spallation Neutron Source. Neutroner er afgørende for at lokalisere brintatomer, som spiller en afgørende rolle i mange af de katalytiske funktioner og lægemiddeldesignbestræbelser.
Proteaseplasmid -DNA'et, der blev brugt til fremstilling af enzymet, blev leveret af Argonnes strukturbiologiske center ved Advanced Photon Source. Krystallisering af proteinerne anvendt i røntgenspredningsforsøgene blev udført på ORNL's Center for Strukturel og Molekylær Biologi.
 Varme artikler
Varme artikler
-
 Video:Hvorfor hader nogle mennesker koriander?Kredit:The American Chemical Society Koriander er et populært krydderi, tilføjer smag til tacos og nudelretter over hele kloden. Men for nogle mennesker, det smager bare af sæbe. Hvad sker der he
Video:Hvorfor hader nogle mennesker koriander?Kredit:The American Chemical Society Koriander er et populært krydderi, tilføjer smag til tacos og nudelretter over hele kloden. Men for nogle mennesker, det smager bare af sæbe. Hvad sker der he -
 Design og genanvendelse af celleceptorerTegneserie, der illustrerer beregningsmæssig manipulation af langtrækkende signaloverførsel i celleceptorer. Kredit:Daniel Keri, EPFL EPFL -forskere har udviklet en beregningsmetode til modellerin
Design og genanvendelse af celleceptorerTegneserie, der illustrerer beregningsmæssig manipulation af langtrækkende signaloverførsel i celleceptorer. Kredit:Daniel Keri, EPFL EPFL -forskere har udviklet en beregningsmetode til modellerin -
 Strukturen af fotosystemprotein-superkompleks fra diatom afslører dets meget sofistikerede energi…Overordnet struktur af PSI-FCPI superkomplekset. Kredit:IBCAS Kiselalger er en gruppe af fytoplankton, der er vidt udbredt i hydrosfæren og endda i fugtig jord. De spiller vigtige roller i globale
Strukturen af fotosystemprotein-superkompleks fra diatom afslører dets meget sofistikerede energi…Overordnet struktur af PSI-FCPI superkomplekset. Kredit:IBCAS Kiselalger er en gruppe af fytoplankton, der er vidt udbredt i hydrosfæren og endda i fugtig jord. De spiller vigtige roller i globale -
 Kemikere forbedrer metoden til at udvinde naturlige antioxidanter fra laurbærbladeKredit:RUDN Universitet En kemiker fra RUDN Universitet og hans kolleger har foreslået at bruge rester fra forarbejdning af laurbærblade som råmateriale til fremstilling af kemisk aktive stoffer,
Kemikere forbedrer metoden til at udvinde naturlige antioxidanter fra laurbærbladeKredit:RUDN Universitet En kemiker fra RUDN Universitet og hans kolleger har foreslået at bruge rester fra forarbejdning af laurbærblade som råmateriale til fremstilling af kemisk aktive stoffer,


