Parasitforskning varmer op
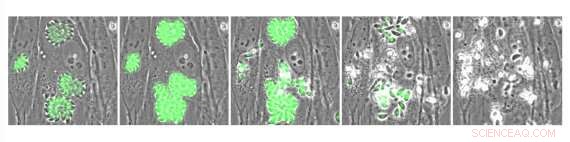
Intracellulære Toxoplasma -parasitter, der udtrykker den genetisk kodede calciumindikator GCaMP. Parasitter blev behandlet med A23187, en forbindelse, der forårsager tilstrømning af calcium og stimulerer parasitudgang. Kredit:Whitehead Institute for Biomedical Research
Apicomplexan parasitter inficerer hundredvis af millioner af mennesker rundt om i verden hvert år. Flere arter af apicomplexan -parasitter i Plasmodium -slægten forårsager malaria, mens en anden apicomplexan -art, Toxoplasma gondii (T. gondii), forårsager toksoplasmose, en sygdom med influenzalignende symptomer, der kan være dødelig for mennesker med svækket immunsystem. På trods af deres indvirkning, biologien af disse sygdomsfremkaldende parasitter er ikke særlig godt forstået, og behandlingsmuligheder for infektion er begrænsede.
En potentiel metode til behandling af infektion kan være lægemidler, der forstyrrer parasittenes calciumsignalering, som de stoler på for at sprede sig fra celle til celle i deres værter. Parasitterne har brug for en tilstrømning af calcium for at bryde ud af en inficeret værtscelle - en proces kaldet udgang - og bevæge sig gennem værtens krop og invadere andre celler. I tidligere arbejde, en forsker fra Whitehead Institute -medlem Sebastian Louridos laboratorium, Saima Sidik, havde testet en stor samling af molekyler og identificeret en kaldet enhancer 1 (ENH1), som forstyrrede parasittenes calciumniveauer og forhindrede udgang, som en lovende anti-parasitisk bly. Imidlertid, de originale eksperimenter afgjorde ikke, hvordan ENH1 virker. I forskning offentliggjort i tidsskriftet ACS kemisk biologi den 29. juni, Alice Herneisen, en kandidatstuderende i Louridos laboratorium, og Lourido, som også er adjunkt i biologi ved Massachusetts Institute of Technology, brugte en fremgangsmåde kaldet termisk proteomprofilering for at opdage, hvordan ENH1 forhindrer T. gondii -parasitter i at komme ud. De identificerede hovedmålet for ENH1 som et calciumafhængigt molekyle kaldet CDPK1, som parasitter bruger til at forberede udgang, bevæger sig mellem celler, og invasion af værtsceller. ENH1 binder til og forhindrer CDPK1 i at fungere.
"Fremskridt i løbet af de sidste årtier har gjort det meget lettere at opdage et molekyls potentielt terapeutiske aktivitet, men det næste trin med at finde ud af, hvordan molekylet fungerer, er ofte stadig en udfordring, "Lourido siger." Ved at anvende nyere ekspansive metoder, vi begynder at bygge et mere holistisk billede af parasittenes cellebiologi. "
Det er vigtigt at forstå den biologi, der er ansvarlig for et potentielt lægemiddels observerede virkninger, fordi de fleste lægemidler kræver modifikation, før de er klar til brug hos mennesker - de skal muligvis gøres mindre giftige, mere potent, eller mere modtagelige for miljøet i den menneskelige krop - og denne form for ændringer kan ikke foretages, før molekylet og dets aktivitet er forstået.
Herneisen besluttede at bruge en relativt ny tilgang til parasitter, termisk proteomprofilering, at opdage målene for ENH1 - de molekyler, det binder sig til, fører til dets terapeutiske virkninger. Fremgangsmåden fungerer ved at tegne, hvordan hvert af proteinerne inde i parasitten reagerer på ændringer i varme med og uden at blive udsat for ENH1. En fordel ved denne tilgang er, at den er upartisk, hvilket betyder, at i stedet for at forskere vælger sandsynlige mål på forhånd for at teste, de undersøger så mange molekyler som muligt, hvilket kan føre til uventede fund. For eksempel, Lourido har undersøgt CDPK1 i andre sammenhænge i mange år, og baseret på hans laboratoriums tidligere forståelse af dets rolle, ville det ikke have forventet, at det ville være et hovedmål for ENH1 - sådanne overraskelser kan lede forskning i spændende nye retninger.
Selvom CDPK1 er ENH1s hovedmål, undersøgelserne afdækkede ikke målet, der gør det muligt for ENH1 at forårsage svingninger i parasittenes calciumniveauer. At finde dette manglende mål er et af laboratoriets næste mål.
"Det faktum, at ENH1 påvirker flere aspekter af calciumsignalering, kan være det, der gør det til et så effektivt antiparasitisk middel, "Herneisen siger." Det roder med parasitterne på flere niveauer. "
Oversættelse af forskningen til klinisk test er langt væk, men der er flere indikatorer på, at dette er en lovende retning for undersøgelse. Ikke alene er calciumsignalering nøglen til parasittenes livscyklus og evne til at sprede sig inde i en vært, men de molekyler og mekanismer, som parasitterne bruger til at modulere calciumniveauer, er meget forskellige fra dem, der findes hos pattedyr. Det betyder, at et lægemiddel, der forstyrrer parasittenes calciumsignalering, usandsynligt vil forstyrre calciumsignalering hos mennesker, og det kan være dødeligt for parasitterne uden at skade patienternes celler.
Sidste artikelHvordan opbygger bakterier naturlige produkter?
Næste artikelSortering og udskillelse af insulin efter udløbsdato
 Varme artikler
Varme artikler
-
 Eksperimentel undersøgelse af, hvordan metalglas former, udfordrer paradigme inden for glasforsknin…Metalliske briller som produceret i Lab på Saarland University. Kredit:Gallino/Busch Medmindre du tilfældigvis er en materialeforsker, hvilket de fleste af os trods alt ikke er, udtrykket briller
Eksperimentel undersøgelse af, hvordan metalglas former, udfordrer paradigme inden for glasforsknin…Metalliske briller som produceret i Lab på Saarland University. Kredit:Gallino/Busch Medmindre du tilfældigvis er en materialeforsker, hvilket de fleste af os trods alt ikke er, udtrykket briller -
 Forskere udvikler mikroskopisk teori om polymergelKredit:National Research University Higher School of Economics Russiske videnskabsmænd har foreslået en teori om fasetransformation i polymergeler. Det forklarer mekanismerne bag den dramatiske re
Forskere udvikler mikroskopisk teori om polymergelKredit:National Research University Higher School of Economics Russiske videnskabsmænd har foreslået en teori om fasetransformation i polymergeler. Det forklarer mekanismerne bag den dramatiske re -
 Hvad er de 4 atommodeller?Atomet er den mest basale enhed i ethvert element, der stadig opretholder egenskaberne ved dette element. Fordi atomer er alt for små til at se, har deres struktur altid været noget af et mysterium. I
Hvad er de 4 atommodeller?Atomet er den mest basale enhed i ethvert element, der stadig opretholder egenskaberne ved dette element. Fordi atomer er alt for små til at se, har deres struktur altid været noget af et mysterium. I -
 Total syntese af cotylenin A til et nyt kræftlægemiddel uden bivirkningerKredit:Nakada Laboratory, Waseda Universitet Det lykkedes for forskere ved Waseda University at udvikle en metode til en total syntese af cotylenin A, en plantevækstregulator, som har tiltrukket s
Total syntese af cotylenin A til et nyt kræftlægemiddel uden bivirkningerKredit:Nakada Laboratory, Waseda Universitet Det lykkedes for forskere ved Waseda University at udvikle en metode til en total syntese af cotylenin A, en plantevækstregulator, som har tiltrukket s
- Gulf Coast klar til at udvikle kulstoflagringshub
- Denne robot hjælper dig med at løfte genstande – ved at se på dine biceps
- Fracking og jordskælv - afvejer farerne i Sydafrika
- Sådan bruges tællere i Math
- Biologiske værktøjer skaber nervelignende polymernetværk
- Klimaforandringerne forventes at stoppe trøffelproduktionen


