Hvordan opbygger bakterier naturlige produkter?
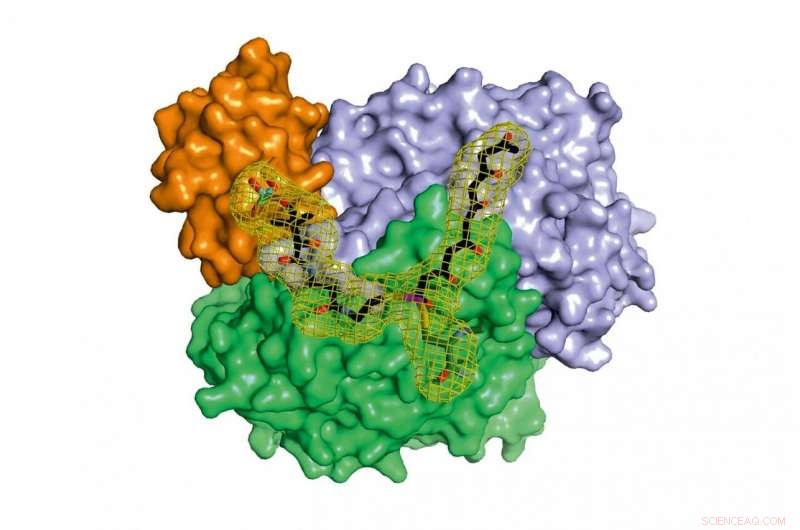
Et kompleks af tre proteiner beskytter det meget reaktive hexaketid, når det forlænges til octaketidet. I samarbejde med andre proteiner, vigtige naturlige stoffer produceres fra det resulterende octaketid. Kredit:Maximilian Schmalhofer og prof. Dr. Michael Groll/TUM
De aktive stoffer i mange lægemidler er naturlige produkter, såkaldt, fordi ofte kun mikroorganismer er i stand til at producere de komplekse strukturer. Ligesom produktionslinjen på en fabrik, store enzymkomplekser sætter disse aktive stofmolekyler sammen. Et team fra det tekniske universitet i München (TUM) og Goethe -universitetet i Frankfurt er nu lykkedes med at undersøge de grundlæggende mekanismer for en af disse molekylfabrikker.
Mange vigtige lægemidler, såsom antibiotika eller aktive midler mod kræft, er naturlige produkter, der opbygges af mikroorganismer, f.eks. Bakterier eller svampe. I laboratoriet, disse naturlige produkter kan ofte slet ikke produceres eller kun med stor indsats. Udgangspunktet for et stort antal af sådanne forbindelser er polyketider, som er carbonkæder, hvor hvert andet atom har en dobbeltbinding til et oxygenatom.
I en mikrobiel celle, såsom i Photorhabdus luminescens -bakterien, de produceres ved hjælp af polyketidsyntaser (PKS). For at opbygge de ønskede molekyler trin for trin, i første fase af PKS type II -systemer, fire proteiner arbejder sammen i skiftende "teams".
I en anden fase, de modificeres derefter til det ønskede naturlige produkt med yderligere enzymer. Eksempler på bakterielle naturprodukter, der produceres på den måde, er, blandt andet, de klinisk anvendte Tetracyclin -antibiotika eller Doxorubicin, et lægemiddel mod kræft.
Tværfagligt samarbejde
Mens de modificerede trin i anden etape er godt undersøgt for mange aktive midler, der har indtil nu næppe været nogen indsigt i den generelle funktion af første fase af disse molekylære fabrikker, hvor det stærkt reaktive polyketid -mellemprodukt er bundet til enzymkomplekset og beskyttet, så det ikke kan reagere spontant.
Dette hul er nu lukket af resultaterne af samarbejdet mellem arbejdsgrupperne i Michael Groll, professor i biokemi ved det tekniske universitet i München, og Helge Bode, professor i molekylær bioteknologi ved Goethe -universitetet i Frankfurt, som er offentliggjort i det anerkendte videnskabelige tidsskrift Naturkemi .
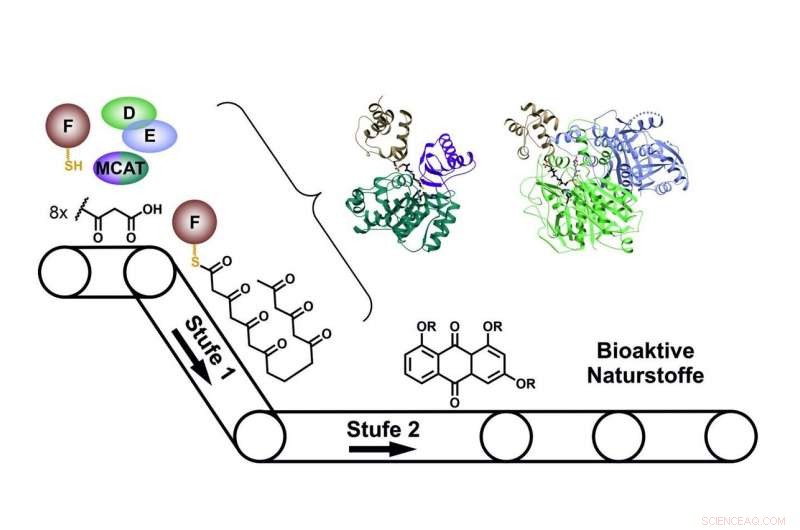
Når man bygger naturprodukter interagerer de enkelte enzymer i Type II PKS -systemet som samlebåndene på en fabrik. Kredit:Prof. Dr. Helge Bode/Goethe-Universitaet Frankfurt
Fund inspirerer til nye synteser af aktive midler
"I forbindelse med dette arbejde, vi var for første gang i stand til at analysere komplekser af de forskellige partnerproteiner af type II polyketidsyntase ved hjælp af røntgenstrukturanalyse og nu forstå den komplette katalytiske cyklus i detaljer, "Michael Groll forklarer.
"Baseret på disse fund, det vil være muligt i fremtiden at manipulere de centrale biokemiske processer målrettet og dermed ændre de grundlæggende strukturer i stedet for at være begrænset til dekorationsenzymerne, ”Tilføjer Helge Bode.
Selvom det er en lang vej at udvikle forbedrede antibiotika og andre lægemidler, begge grupper er optimistiske med, at nu også strukturen og mekanismen for de manglende dele af molekylfabrikken kan forklares. "Vi har allerede lovende data om de yderligere proteinkomplekser, "siger Maximilian Schmalhofer, der var involveret i undersøgelsen som doktorand i München.
Sidste artikelNye høje protonledere med iboende iltmangel lag åbner en bæredygtig fremtid
Næste artikelParasitforskning varmer op
 Varme artikler
Varme artikler
-
 Gyroskopmolekyler danner krystal, der er både fast og fuld af bevægelseUCLA -forskere dannede en krystal ud af molekyler, der hver har et solidt ydre, men indeholder bevægelige dele. Kredit:Kendall Houk Laboratory/UCLA Molekylære maskiner, meget mindre end enkeltcell
Gyroskopmolekyler danner krystal, der er både fast og fuld af bevægelseUCLA -forskere dannede en krystal ud af molekyler, der hver har et solidt ydre, men indeholder bevægelige dele. Kredit:Kendall Houk Laboratory/UCLA Molekylære maskiner, meget mindre end enkeltcell -
 Hurtige og pålidelige tests for legionellabakterier i vandKredit:Giovanni Cancemi, Shutterstock En fuldautomatisk testanordning kan nu installeres på vandsteder, der er mistænkt for forurening med legionella-bakterier. Enheden lover mere pålidelige resul
Hurtige og pålidelige tests for legionellabakterier i vandKredit:Giovanni Cancemi, Shutterstock En fuldautomatisk testanordning kan nu installeres på vandsteder, der er mistænkt for forurening med legionella-bakterier. Enheden lover mere pålidelige resul -
 ROSINA spektrale målinger vækker komets kemi til liveArbejdshestinstrument ROSINA-DFMS (Rosetta Orbiter Sensor til Ion- og Neutral Analysis-Double Focusing Mass Spectrometer). Kredit:University of Bern Lanceret marts 2004 og efter en 10-årig rejse o
ROSINA spektrale målinger vækker komets kemi til liveArbejdshestinstrument ROSINA-DFMS (Rosetta Orbiter Sensor til Ion- og Neutral Analysis-Double Focusing Mass Spectrometer). Kredit:University of Bern Lanceret marts 2004 og efter en 10-årig rejse o -
 Fælles lægemiddelkilde til indsigt i dannelsen af sommerfuglekrystallerKredit:Australian Nuclear Science and Technology Organisation (ANSTO) Eksperimenter ved ANSTOs australske center for neutronspredning og den australske synkrotron har afsløret vækstmekanismen bag
Fælles lægemiddelkilde til indsigt i dannelsen af sommerfuglekrystallerKredit:Australian Nuclear Science and Technology Organisation (ANSTO) Eksperimenter ved ANSTOs australske center for neutronspredning og den australske synkrotron har afsløret vækstmekanismen bag
- Giraffernes tilpasning i græslandene
- Hvor højt over havets overflade er jeg? stiller det forkerte spørgsmål
- Russias RT ryger efter Facebook blokerer vildt populær side
- Kinesisk privat firma opsender den første rumraket
- Hvordan livet er ombord på SpaceX Dragon-kapslen
- Hvordan man laver hjemmelavet lim ud af mælk til et videnskabsprojekt


