Konstruerede bakterier udskiller kræftbiomarkører
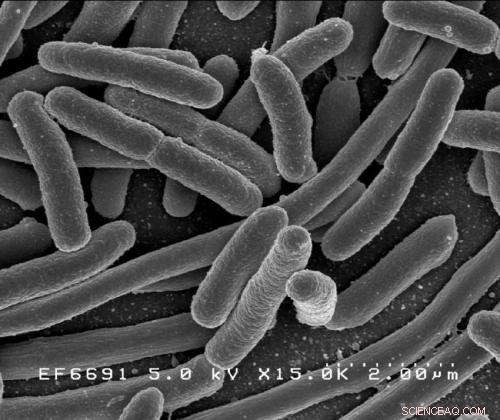
Escherichia coli. Kredit:Rocky Mountain Laboratories, NIAID, NIH
Skam med glycanen - disse komplekse sukkermolekyler er knyttet til 80% af proteinerne i den menneskelige krop, gør dem til en væsentlig ingrediens i livet. Men denne proces, kendt som glykosylering, er blevet lidt overskygget af flashere biomolekylære processer såsom transkription og translation.
"Glycosylering er helt afgørende for liv på denne planet. Og alligevel, vi ved stadig relativt lidt om det, " sagde Matthew DeLisa, William L. Lewis professor i ingeniørvidenskab ved Smith School of Chemical and Biomolecular Engineering. "Mens meget opmærksomhed er blevet givet til at forstå genomet og proteomet, glykomet - som repræsenterer hele komplementet af sukkerarter, enten fri eller til stede i mere komplekse molekyler såsom glykoproteiner, af en organisme - er blevet relativt understuderet. Vi har brug for nye værktøjer til at fremme feltet."
DeLisas laboratorium har skabt netop disse værktøjer ved at befale enkle, encellede mikroorganismer — nemlig E coli bakterier - og manipulere dem til at udforske den komplekse proces med glykosylering og den funktionelle rolle, som proteinbundne glykaner spiller i sundhed og sygdom.
Gruppens papir, "Engineering af ortogonal human O-linked glycoprotein biosyntese i bakterier, " udgivet 27. juli i Naturens kemiske biologi . Hovedforfatteren er Aravind Natarajan, Ph.D. '19.
Tidligere, DeLisas team brugte en lignende celle glyco-engineering tilgang til at producere en af de mest almindelige typer af glycoproteiner - dem med glycan strukturer knyttet til aminosyren asparagin, eller N-bundet. Nu har forskerne vendt deres opmærksomhed mod et andet rigeligt glykoprotein, nemlig O-bundet, hvor glycaner er knyttet til oxygenatomet i serin eller threonin-aminosyrer i et protein.
De O-bundne glycaner er mere strukturelt forskellige end deres N-forbundne fætre, og de har vigtige implikationer i udviklingen af nye terapeutiske behandlinger for sygdomme som brystkræft.
"Vores cellekonstruktionsindsats var ret kompliceret, da vi ikke kun skulle udstyre E coli med det komplette sæt af enzymer til fremstilling og fastgørelse af glycanstrukturer til proteiner, men vi var også nødt til omhyggeligt at omkoble native metaboliske netværk for at sikre tilgængeligheden af vigtige glycan-byggesten såsom sialinsyre, "Natarajan sagde. "Tilsætningen af sialinsyre til vores glykoproteiner er betydelig, fordi denne sukkerrester ofte er afgørende for at målrette lægemidler til specifikke celler og øge deres cirkulationshalveringstid."
Når en celle bliver kræft, det udtrykker visse biomarkører, inklusive unormalt glykosylerede overfladeproteiner, som indikerer tilstedeværelsen af kræft. DeLisas gruppe udstyret E coli med maskineriet til at producere sådanne proteiner, inklusive en, der lignede en fremtrædende cancerbiomarkør, mucin 1 (MUC1).
"Den glykosylerede version af MUC1 er et af de højest prioriterede målantigener til cancerterapi. Det har været meget udfordrende at udvikle behandlinger mod dette mål, " sagde DeLisa, avisens seniorforfatter. "Men ved at have et biosyntetisk værktøj som det, vi har skabt, der er i stand til at replikere MUC1-strukturen, vi håber på, at dette kan give glycoproteinreagenser, der kan udnyttes til at opdage antistoffer eller anvendes direkte som immunterapier, som alle kunne hjælpe i kampen mod visse former for kræft."
Både O-koblede og N-forbundne glycaner er også blevet opdaget i et af overfladeproteinerne af SARS-CoV-2-virus, som forårsager COVID-19. DeLisa håber, at hans gruppes metode til bakteriel celle glyco-engineering vil åbne døren for at skabe glycosylerede versioner af dette S-protein, der kan føre til terapeutiske antistoffer mod coronavirus, eller udvikling af en underenhedsvaccine.
På grund af deres tidligere arbejde med at replikere N-bundne glykaner, forskerne var i stand til at få det O-forbundne system op at køre hurtigt. Nu er DeLisas laboratorium klar til at lave proteiner, der bærer begge typer glykosylering, hvilket er vigtigt, fordi mange glykoproteiner, såsom S-proteinet i SARS-CoV-2, bærer både N- og O-bundne glycanstrukturer.
Forskerne udforsker også måder at øge spektret af glycoproteiner, som de har udviklet E coli celler kan producere og den effektivitet, hvormed disse produkter genereres.
"Vi tænker på E coli som et rent chassis eller en blank tavle, når det kommer til proteinglykosylering, fordi disse bakterier normalt ikke udfører glykosyleringsreaktioner som dem, vi har installeret, "DeLisa sagde. "Dette tillader konstruktion af disse veje fra bunden og op, giver os total kontrol over de typer af glykanstrukturer, der laves, og de specifikke steder i målproteiner, hvor de er knyttet. Det er et kontrolniveau, der er vanskeligt at opnå med andre allerede eksisterende cellebaserede systemer eller teknologier til glycoproteinteknologi."
 Varme artikler
Varme artikler
-
 Ultralydsvibrationer tvinger en polymer til at være en halvlederDesign af mekanisk kemisk frembragt konjugeret polymer. (A) Isolerende CBE -mekanoforer forbundet med π -systemer, designet til at omarrangere til kontinuerligt forlænget konjugering under kraft. (B)
Ultralydsvibrationer tvinger en polymer til at være en halvlederDesign af mekanisk kemisk frembragt konjugeret polymer. (A) Isolerende CBE -mekanoforer forbundet med π -systemer, designet til at omarrangere til kontinuerligt forlænget konjugering under kraft. (B) -
 Polymerer kan beskytte bygninger mod store fejlbrudLuftfoto af et mere end 30 km langt overfladebrud observeret i Meckering Western Australia i 1968 som følge af et jordskælv på 6,6. Kredit:fintbo/Flickr Overfladebrud under jordskælv er en betydel
Polymerer kan beskytte bygninger mod store fejlbrudLuftfoto af et mere end 30 km langt overfladebrud observeret i Meckering Western Australia i 1968 som følge af et jordskælv på 6,6. Kredit:fintbo/Flickr Overfladebrud under jordskælv er en betydel -
 En ny udsigt til brillerKredit:CC0 Public Domain Forskere ved University of Tokyo introducerede en ny fysisk model, der forudsiger dynamikken i glasagtige materialer udelukkende baseret på deres lokale grad af atomstrukt
En ny udsigt til brillerKredit:CC0 Public Domain Forskere ved University of Tokyo introducerede en ny fysisk model, der forudsiger dynamikken i glasagtige materialer udelukkende baseret på deres lokale grad af atomstrukt -
 Omdanne cirkler til firkanter:Forskere omkonfigurerer materialetopologi på mikroskalaenForskere kodede mønstre og design ind i materialet ved at lave små, usynlige justeringer af geometrien af det trekantede gitter. Kredit:Shucong Li/Bolei Deng/Harvard SEAS Rekonfigurerbare materi
Omdanne cirkler til firkanter:Forskere omkonfigurerer materialetopologi på mikroskalaenForskere kodede mønstre og design ind i materialet ved at lave små, usynlige justeringer af geometrien af det trekantede gitter. Kredit:Shucong Li/Bolei Deng/Harvard SEAS Rekonfigurerbare materi
- Billede:Hubbles udsøgte udsigt over en stjernekammer
- Nyt superomnifobisk glas svæver højt på sommerfuglevingerne ved hjælp af maskinlæring
- Shape-morphing leddene tillader disse små robotter at overvinde forhindringer
- Ny teknologi vil identificere kilder til plast i havet
- Hvad er drømme?
- Ring of Fire -vulkaner minder Asien om seismisk fare


