Forskere afslører dobbelt specificitet af Vav2-SH2-protein
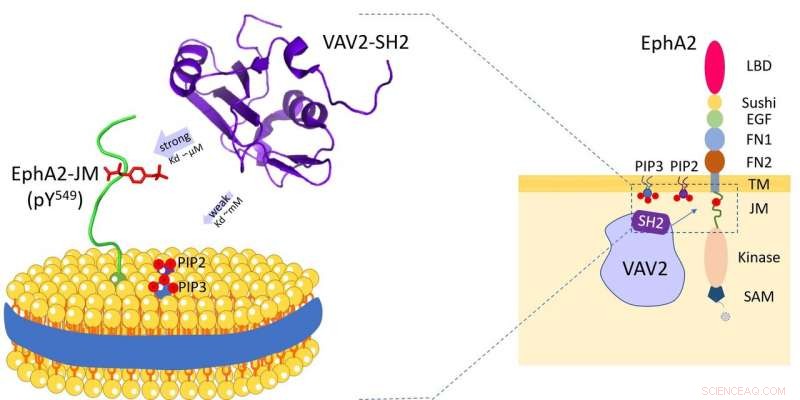
Vav2-protein binder til cellemembranfosfolipider og receptortyrosinkinase EphA2 juxtamembranregionen. Kredit:HFIPS
For nylig, et forskerhold ledet af prof. Wang Junfeng fra High Magnetic Field Laboratory, Hefei Institutes of Physical Science afslørede den dobbelte specificitet af Vav2-SH2-protein efter at have undersøgt den specifikke genkendelsesmekanisme af humant Vav2-protein med cellemembranfosfolipider og receptortyrosinkinase EphA2 juxtamembranregionen.
Vav2 udtrykkes bredt i menneskelige væv og spiller væsentlige roller i forskellige biologiske processer. Og gennem dets Src-homology 2 (SH2) domæne, Vav2 er i stand til at interagere med flere transmembrane receptorer. Disse SH2-medierede interaktioner finder sted på eller i nærheden af plasmamembranen og er afgørende for, at Vav2 kan formidle forskellige ekstracellulære signaltransduktioner.
I denne forskning, ved hjælp af nuklear magnetisk resonans (NMR) teknikker, forskerne opdagede fosfolipidmiljøets rolle på protein-protein-interaktion, tilbyder en potentiel metode til at studere denne interaktion i det samme miljø under nær fysiologiske forhold.
Forskerne afslørede, at Vav2-SH2-domænet specifikt bandt til den Y594-phosphorylerede juxtamembranregion ved hjælp af dets konserverede proteinbindingssted. Interessant nok, det havde også phospholipidbindingsevnen og phospholipidbindingsstedet for Vav2-SH2, ved siden af proteinbindingsstedet blev bestemt ved NMR-forsøg.
Desuden, forskerne brugte lipid nanodiske til at efterligne membranen, og afdækkede membranmiljøets rolle i moduleringen af denne protein-protein-genkendelse.
 Varme artikler
Varme artikler
-
 Kuldioxid-til-methanol-proces forbedret med katalysatorChunshan Song, venstre, og Xiao Jiang er to Penn State-forskere, der undersøger måder at bruge kuldioxid som råmateriale til at skabe brændstoffer og materialer. Song er direktør for EMS Energy Instit
Kuldioxid-til-methanol-proces forbedret med katalysatorChunshan Song, venstre, og Xiao Jiang er to Penn State-forskere, der undersøger måder at bruge kuldioxid som råmateriale til at skabe brændstoffer og materialer. Song er direktør for EMS Energy Instit -
 Lys giver kontrol til 3D-udskrivning med flere materialerDe øverste billeder viser det digitale design og dets trykte form. Lilla svarer til ultraviolet hærdede stive epoxidområder, der henviser til, at de grå områder er synligt lyshærdede acrylatområder, d
Lys giver kontrol til 3D-udskrivning med flere materialerDe øverste billeder viser det digitale design og dets trykte form. Lilla svarer til ultraviolet hærdede stive epoxidområder, der henviser til, at de grå områder er synligt lyshærdede acrylatområder, d -
 5. klasse kemisk forandringsaktivitetEt kemiprojekt for 5. graders bør fremstå som sjovt og mindre som læring. Illustrerende en kemisk reaktion ved at ændre farven på en øre passer til regningen. Dette er et eksperiment, som en 10-årig k
5. klasse kemisk forandringsaktivitetEt kemiprojekt for 5. graders bør fremstå som sjovt og mindre som læring. Illustrerende en kemisk reaktion ved at ændre farven på en øre passer til regningen. Dette er et eksperiment, som en 10-årig k -
 Træk jern ud af spildprintertonerKredit:American Chemical Society En skønne dag, rester af toner i kasserede printerpatroner kan have et nyt liv som bro eller bygningsdele i stedet for som skraldespand, spilde væk på lossepladser
Træk jern ud af spildprintertonerKredit:American Chemical Society En skønne dag, rester af toner i kasserede printerpatroner kan have et nyt liv som bro eller bygningsdele i stedet for som skraldespand, spilde væk på lossepladser
- Subducerende plader af jordskorpen kan generere usædvanlige træk, der er plettet nær kernen
- Ny DNA-baseret chip kan programmeres til at løse komplekse matematiske problemer
- Lyst brændende meteor set over store områder af Japan
- Næsten 60 broer, 2, 000 huse ødelagt af tyfon i Nordkorea
- Vi har et sundt rumfartøj:NASA lykkes med at flyve forbi den fjerne verden
- Ny teori viser, at den ejendommelige Janus-grænseflade er en fælles mekanisme i kulstofnanorørs v…


