Når aktivt stof og målprotein omfavner hinanden
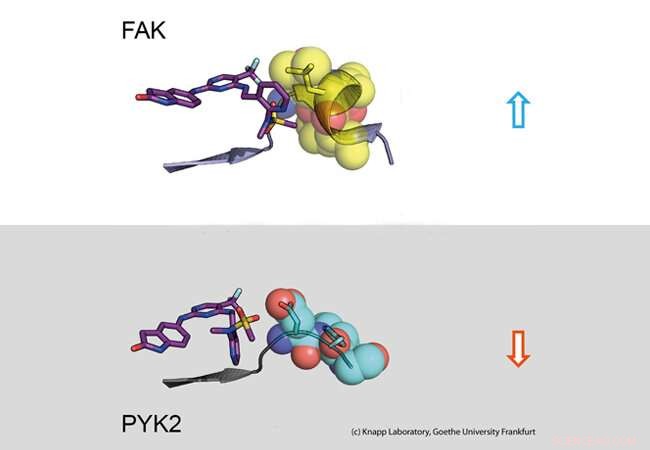
Øverste del:Lang opholdstid. En inhibitor (til venstre:stick -model) binder sig til signalmolekylet FAK (til højre:en del af FAK -proteinet afbildet som calottemodel med kugler). Strukturændringen af FAK forårsager hydrofobe kontakter (gul, såkaldt DFG-motiv) og et langvarigt engagement. Nedre del:Kort opholdstid. PYK2 -signalprotein ændrer ikke sin struktur ved inhibitorbinding, hvilket resulterer i en hurtig inhibitor dissociation. Kredit:Knapp Laboratory, Goethe Universitet Frankfurt
Mange lægemidler mod kræft blokerer signaler i kræftceller, der hjælper degenererede celler til at formere sig ukontrollabelt og løsne sig fra væv. For eksempel, blokering af signalproteinet FAK, en såkaldt kinase, får brystkræftceller til at blive mindre mobile og dermed mindre tilbøjelige til at metastasere. Problemet er, at når FAK blokeres af en hæmmer, det nært beslægtede signalprotein PYK2 bliver meget mere aktivt og overtager dermed nogle af FAKs opgaver. Det ideelle ville derfor være en hæmmer, der hæmmer både FAK og PYK2 på samme måde så længe som muligt.
Et internationalt team ledet af lægemiddelkemikeren Prof. Stefan Knapp fra Goethe University har undersøgt en række specielt syntetiserede FAK -hæmmere. Alle inhibitorer bundet til FAK -proteinet med omtrent samme hastighed. Imidlertid, de var forskellige i bindingsvarigheden:Den mest effektive inhibitor forblev bundet til FAK -signalproteinet længst.
Ved hjælp af strukturelle og molekylærbiologiske analyser samt computersimuleringer, forskergruppen opdagede, at binding af hæmmere, der forbliver i FAK -bindingslommen i lang tid, fremkalder en strukturel ændring. Dermed, ved binding af disse hæmmere, FAK ændrer form og danner en specifik, vandafvisende struktur på kontaktsteder med inhibitoren, kan sammenlignes med en intim omfavnelse.
Det nært beslægtede protein PYK2, på den anden side, forblev forholdsvis stiv, og selvom den mest effektive FAK -hæmmer også blokerede PYK2, dens virkning var signifikant svagere på grund af hurtigt dissociering af inhibitorer fra bindingsstedet. Interessant nok, computersimuleringer var i stand til at forudsige bindingskinetikken meget godt, tilvejebringelse af en metode til nøjagtig simulering af lægemiddeldissociationshastigheder til fremtidig optimering af lægemiddelkandidater.
Stefan Knapp forklarer, "Fordi vi nu har en bedre forståelse af de molekylære mekanismer ved interaktionen mellem potente inhibitorer af disse to kinaser, Vi håber at kunne bruge computersimuleringer til bedre at forudsige lægemiddeltid for hæmmere og lægemiddelkandidater i fremtiden. Indtil nu, lidt opmærksomhed er blevet lagt på de kinetiske egenskaber ved lægemiddelbinding. Imidlertid, denne egenskab er nu fremstået som en vigtig parameter for udviklingen af mere effektive lægemidler, der er designet til at hæmme deres målproteiner - som i tilfældet med FAK og PYK2 - ikke kun kraftigt, men også i lang tid. "
 Varme artikler
Varme artikler
-
 Kemikere udvikler et nyt miljøvenligt materiale til spildevandsrensningKredit:Allen Dressen RUDN -kemikere har udviklet en hybrid nanokatalysator til hurtig fjernelse af stabile organiske farvestoffer fra spildevand. Denne katalysator kræver ikke yderligere aggressiv
Kemikere udvikler et nyt miljøvenligt materiale til spildevandsrensningKredit:Allen Dressen RUDN -kemikere har udviklet en hybrid nanokatalysator til hurtig fjernelse af stabile organiske farvestoffer fra spildevand. Denne katalysator kræver ikke yderligere aggressiv -
 Sort silicium kan hjælpe med at opdage sprængstoffer(a) Skematisk illustration af fremstillingsproceduren. (b) SEM-billede fra siden (synsvinkel på 40?) af den funktionaliserede b-Si-indsats viser blottet b-Si til sammenligning). (c) Si 2p højopløsning
Sort silicium kan hjælpe med at opdage sprængstoffer(a) Skematisk illustration af fremstillingsproceduren. (b) SEM-billede fra siden (synsvinkel på 40?) af den funktionaliserede b-Si-indsats viser blottet b-Si til sammenligning). (c) Si 2p højopløsning -
 Sådan beregnes PH af pufferløsningerEn puffer er en vandig opløsning designet til at opretholde en konstant pH, selv når den udsættes for små mængder syrer eller baser. Uanset om det er surt (pH 7), består en pufferopløsning af en svag
Sådan beregnes PH af pufferløsningerEn puffer er en vandig opløsning designet til at opretholde en konstant pH, selv når den udsættes for små mængder syrer eller baser. Uanset om det er surt (pH 7), består en pufferopløsning af en svag -
 Brudsejhed af materialet til flykonstruktion øges med 1,5 gangeKredit:Pixabay/CC0 Public Domain Forskere fra NUST MISIS har fundet en måde at øge brudsejheden af siliciumcarbid, et lovende konstruktionsmateriale til fremstilling af ildfaste dele, 1,5 gange.
Brudsejhed af materialet til flykonstruktion øges med 1,5 gangeKredit:Pixabay/CC0 Public Domain Forskere fra NUST MISIS har fundet en måde at øge brudsejheden af siliciumcarbid, et lovende konstruktionsmateriale til fremstilling af ildfaste dele, 1,5 gange.
- Droner vil snart beslutte, hvem de skal dræbe
- Baidu -overskuddet falder, men indtægterne overgår forventningerne
- Sådan beregner du Kb fra Ka
- Optisk detektion af picomolære koncentrationer af RNA ved hjælp af switches i plasmonisk chiralite…
- Monsunregn regner i indias finansielle kapital
- Plasma-stråler stabiliserer vand til at sprøjte mindre


