Forskere afdækker strukturen af lysdrevet enzym med potentielle anvendelser af biobrændstof
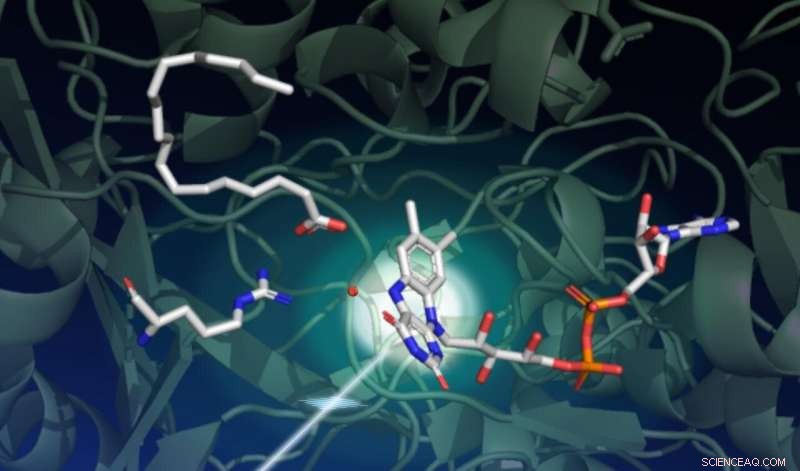
En undersøgelse med SLACs LCLS røntgenlaser fangede, hvordan lys driver en række komplekse strukturelle ændringer i et enzym kaldet FAP, som katalyserer omdannelsen af fedtsyrer til udgangsbestanddele til opløsningsmidler og brændstoffer. Denne tegning fanger starttilstanden for den katalytiske reaktion. Den mørkegrønne baggrund repræsenterer proteinstilladset. Enzymets lysfølende del, kaldet FAD -kofaktoren, er vist i midten til højre med sine tre ringe, der absorberer en foton, der kommer nedefra til venstre. En fedtsyre øverst til venstre venter på transformation. Aminosyren vist i midten til venstre spiller en vigtig rolle i den katalytiske cyklus, og den røde prik nær midten er et vandmolekyle. Kredit:Damien Sorigue/Universite Aix-Marseille
Selvom mange organismer fanger og reagerer på sollys, enzymer - proteiner, der katalyserer biokemiske reaktioner - drives sjældent af lys. Forskere har hidtil kun identificeret tre typer af naturlige fotoenzymer. Den nyeste, opdaget i 2017, er fedtsyre -fotodecarboxylase (FAP). Afledt af mikroskopiske alger, det bruger blåt lys til at katalysere omdannelsen af fedtsyrer, findes i fedtstoffer og olier, i alkaner og alkener.
"Et stigende antal laboratorier forestiller sig at bruge FAP'er til grøn kemi -applikationer, fordi alkaner og alkener er vigtige komponenter i opløsningsmidler og brændstoffer, herunder benzin og jetbrændstoffer. Og omdannelsen af fedtsyrer til alkaner eller alkener sker i et enkelt trin i enzymet, "siger Martin Weik, leder af en forskningsgruppe ved Institute of Biologie Structurale ved Universite Grenoble Alpes.
Weik er en primær efterforsker af en ny undersøgelse, der har fanget den komplekse sekvens af strukturelle ændringer, FAP gennemgår som reaktion på lys, kaldes en fotocyklus, som driver denne fedtsyretransformation. Selvom forskere tidligere foreslog en FAP fotocyklus, den grundlæggende mekanisme blev ikke forstået. Forskerne vidste ikke, hvor lang tid det tog en fedtsyre at miste sit carboxylat, den kemiske gruppe knyttet til slutningen af sin lange kæde af kulbrinter, et kritisk trin i dannelsen af alkener eller alkaner.
I samarbejde med SLAC -forskere eksperimenter ved Linac Coherent Light Source (LCLS) ved Department of Energy's SLAC National Accelerator Laboratory hjalp med at besvare mange af disse fremragende spørgsmål. Forskerne beskriver deres resultater i Videnskab .
Alle værktøjerne i en værktøjskasse
For at forstå et lysfølsomt enzym som FAP, forskere bruger mange forskellige teknikker til at studere processer, der finder sted over en lang række tidsskalaer - fordi fotonabsorption sker i femtosekunder, eller milliontedele af en milliarddel af et sekund, mens biologiske reaktioner på molekylært niveau ofte sker i tusindedele af et sekund.
"Vores internationale, tværfagligt konsortium, ledet af Frederic Beisson ved Universite Aix-Marseille, brugte et væld af teknikker, herunder spektroskopi, krystallografi og beregningsmetoder "Weik siger." Det er summen af disse forskellige resultater, der gjorde det muligt for os at få et første glimt af, hvordan dette unikke enzym fungerer som en funktion af tid og i rummet. "
Konsortiet studerede først de komplekse trin i den katalytiske proces på deres hjemmelaboratorier ved hjælp af optiske spektroskopimetoder, som undersøger den elektroniske og geometriske struktur af atomer i prøverne, herunder kemisk binding og ladning. Spektroskopiske eksperimenter identificerede enzymets mellemliggende tilstande, der ledsager hvert trin, målte deres levetid og gav oplysninger om deres kemiske natur. Disse resultater motiverede behovet for de ultrahurtige muligheder i LCLS.
Næste, et strukturelt billede af den katalytiske proces blev tilvejebragt ved seriel femtosekundskrystallografi (SFX) med LCLS røntgenfri elektronelaser (XFEL). Under disse forsøg, en stråle af små FAP -mikrokrystaller blev ramt med optiske laserpulser for at starte den katalytiske reaktion, efterfulgt af ekstremt kort, ultralette røntgenpulser til måling af de resulterende ændringer i enzymets struktur.
Ved at integrere tusinder af disse målinger-erhvervet ved hjælp af forskellige tidsforsinkelser mellem de optiske og røntgenpulser-var forskerne i stand til at følge strukturelle ændringer i enzymet over tid. De bestemte også strukturen af enzymets hviletilstand ved sondering uden den optiske laser.
Overraskende, forskerne fandt ud af, at i hviletilstand, enzymets lysfølende del, kaldet FAD -kofaktoren, har en bøjet form. "Denne kofaktor fungerer som en antenne til at fange fotoner. Den absorberer blåt lys og starter den katalytiske proces, "Weik siger." Vi troede, at udgangspunktet for FAD -kofaktoren var plant, så denne bøjede konfiguration var uventet. "
FAD-kofaktorens bøjede form blev faktisk først opdaget ved røntgenkrystallografi ved European Synchrotron Radiation Facility, men forskerne mistænkte, at denne bøjning var en artefakt af strålingsskader, et fælles problem for krystallografiske data indsamlet ved synkrotronlyskilder. Kun SFX -eksperimenter kunne bekræfte denne usædvanlige konfiguration på grund af deres unikke evne til at fange strukturel information, før prøven beskadiges, Siger Weik.
"Disse eksperimenter blev suppleret med beregninger, "tilføjer han, "Uden kvantumberegninger på højt niveau udført af Tatiana Domratcheva fra Moscow State University, vi ville ikke have forstået vores eksperimentelle resultater. "
Næste skridt
På trods af den forbedrede forståelse af FAP's fotocyklus, ubesvarede spørgsmål forbliver. For eksempel, forskere ved, at kuldioxid dannes under et bestemt trin i den katalytiske proces på et bestemt tidspunkt og sted, men de kender ikke dets tilstand, da det forlader enzymet.
"I fremtidigt XFEL -arbejde, vi ønsker at identificere produkternes art og tage billeder af processen med en meget mindre trinstørrelse for at løse processen i meget finere detaljer, "siger Weik." Dette er vigtigt for grundforskning, men det kan også hjælpe forskere med at ændre enzymet til at udføre en opgave for en bestemt applikation. "
Sidste artikelFotoudvidelse:Biobaserede polyestere hård film
Næste artikelNy katalysator til lavere kuldioxidemissioner
 Varme artikler
Varme artikler
-
 Ingeniører producerer langvarig, energitæthed batteriEt kig inde i energitætheden mangandioxid-zinkbatteri udviklet på CCNY. Kredit:City College i New York En ny generation af mangandioxid-zinkbatterier med hidtil uset cyklusliv og energitæthed er d
Ingeniører producerer langvarig, energitæthed batteriEt kig inde i energitætheden mangandioxid-zinkbatteri udviklet på CCNY. Kredit:City College i New York En ny generation af mangandioxid-zinkbatterier med hidtil uset cyklusliv og energitæthed er d -
 Kigger ind i flammerne fra ioniske vindeKredit:King Abdullah University of Science and Technology Nye 3D-visualiseringer, der afslører, hvordan flammer reagerer på elektriske felter, kan hjælpe med at forbedre forbrændingseffektiviteten
Kigger ind i flammerne fra ioniske vindeKredit:King Abdullah University of Science and Technology Nye 3D-visualiseringer, der afslører, hvordan flammer reagerer på elektriske felter, kan hjælpe med at forbedre forbrændingseffektiviteten -
 Giftforskning kan give behandling af mave-tarmsygdommeTerapeutik inspireret af gifte kan være nøglen til behandling af en almindelig mave-tarmsygdom. Kredit:University of Queensland Terapeutik inspireret af gifte kan være nøglen til behandling af en
Giftforskning kan give behandling af mave-tarmsygdommeTerapeutik inspireret af gifte kan være nøglen til behandling af en almindelig mave-tarmsygdom. Kredit:University of Queensland Terapeutik inspireret af gifte kan være nøglen til behandling af en -
 Hvordan nye materialer øger effektiviteten af direkte ethanolbrændselscellerMaterialet består af Nafion med indlejrede nanopartikler. Kredit:B.Matos/IPEN Ethanol har fem gange højere volumetrisk energitæthed (6,7 kWh/L) end brint (1,3 kWh/L) og kan sikkert bruges i brænds
Hvordan nye materialer øger effektiviteten af direkte ethanolbrændselscellerMaterialet består af Nafion med indlejrede nanopartikler. Kredit:B.Matos/IPEN Ethanol har fem gange højere volumetrisk energitæthed (6,7 kWh/L) end brint (1,3 kWh/L) og kan sikkert bruges i brænds
- Ny automatiseret proces gør vurdering af nanofiberfremstilling 30 % mere nøjagtig
- Grundlæggende krav til vækst i prokaryoter og eukaryoter
- Måder at reducere jordforurening
- Hvordan man identificerer hvepsneder
- Tilskud, vejr, og finansiel uddannelse fremmer landbrugsforsikringsadoption
- Beregningsmodellering kan snart hjælpe forskere med at forudsige, og forebygge, fødevareusikkerhed


