Ændring af kulhydrater til lipider til mikroalger biobrændstoffer
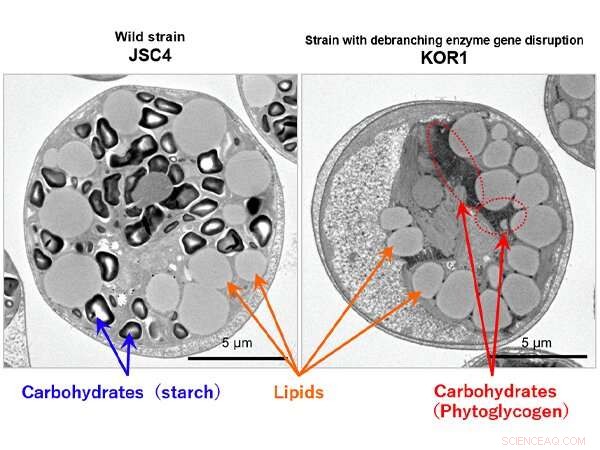
Figur 1:Elektronmikroskopbillede af lipidproduktion i mikroalgerne Chlamydomonas sp. Kredit:Kobe University
Et tværinstitutionelt samarbejde har udviklet en teknik til at fordele kulstofressourcer fra kulhydrater til lipider i mikroalger. Det er håbet, at denne metode kan anvendes til produktion af biobrændstoffer. Denne opdagelse var resultatet af et samarbejde mellem en forskningsgruppe ved Kobe Universitets Engineering Biology Research Center bestående af projektassistent professor Kato Yuichi og professor Hasunuma Tomohisa et al., og seniorforsker Satoh Katsuya et al. ved Takasaki Advanced Radiation Research Institute i Quantum Beam Science Research Directorate (nationale institutter for kvante- og radiologisk videnskab og teknologi).
Disse forskningsresultater blev offentliggjort i det internationale akademiske tidsskrift Kommunikationsbiologi .
Biobrændstoffer er vedvarende ressourcer, der har fået stor opmærksomhed i retning af at skabe mere bæredygtige samfund. Mikroalger er fotosyntetiske organismer, der er yderst i stand til at producere lipider fra kuldioxid i atmosfæren, gør dem til lovende kandidater til produktion af biobrændstoffer. Imidlertid, en forskningsgruppe ved Kobe University bestående af projektassistent professor Kato Yuichi og professor Hasunuma Tomohisa et al. opdagede, at størstedelen af kulstofressourcerne blev omdirigeret til stivelsesproduktion i stedet for lipidproduktion under lys/mørke forhold (dvs. dag og nat). Dette er et problem, når man dyrker mikroalger udenfor.
Forskningsmetodik
Til denne undersøgelse, Projektassistent professor Kato og professor Hasunumas forskningsgruppe ved Kobe University samarbejdede med seniorforsker Satoh et al. ved de nationale institutter for kvante- og radiologisk videnskab og teknologi (QST). Forskerne brugte ionstrålen ved QSTs Takasaki Advanced Radiation Research Institute til at fremkalde mutation i mikroalgerne. Dette gjorde dem i stand til at dyrke en ny mutantstamme kaldet Chlamydomonas sp. KOR1, som kan producere store mængder lipider selv under lyse/mørke forhold.
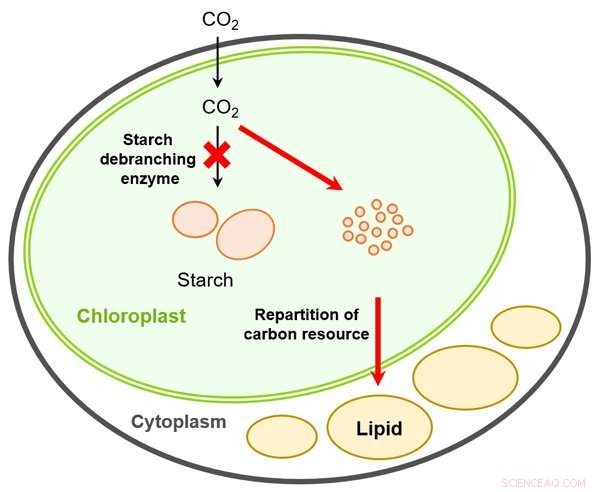
Figur 2:Lipidproduktionsmodel skabt ved at forstyrre stivelsesafgreningsenzymet i mikroalger.
Forskerne opdagede, at denne KOR1 -stamme har forstyrrelser i stivelsesafgrenende enzymgenet ISA1, får det til at producere et andet kulhydrat:fytoglycogen i stedet for stivelse (figur 1).
Normalt, mikroalger syntetiserer og akkumulerer kulhydrater (stivelse) i lysperioder og nedbryder dem, når det er mørkt. Imidlertid, der samler sig mange kulhydrater, der ikke kan brydes helt ned. I modsætning til dette, kulhydraterne syntetiseret af KOR1 (phytoglycogen) blev fuldstændigt nedbrudt i den mørke periode. Resultaterne af KOR1-metabolomanalysen afslørede en total stigning i mellemmetabolitter i både stivelses- og lipidsyntesebanerne (mellemmetabolitter inkluderede fructose-6-phosphat, glucose-6-phosphat, acetyl-CoA og glycerol 3-phosphat). Ud fra denne analyse, forskerne belyste den metaboliske mekanisme, der ligger til grund for den øgede lipidproduktion, der skyldes ISA1 -genforstyrrelse. I KOR1 -stammen, kulhydratet (phytoglycogen) blev hurtigt nedbrudt, og mellemliggende metabolitter foranledigede efterfølgende carbonressourcen til at blive fordelt til lipidproduktion (figur 2).
For at producere biobrændstoffer ved hjælp af mikroalger, det er nødvendigt at dyrke disse organismer udenfor i sollyset. Imidlertid, der er et uundgåeligt fald i lipidproduktionen under disse lys/mørke forhold. Teknikken med at 'fordele kulstofressourcer ved at forstyrre stivelsesafgreningsenzymgenet' udviklet gennem denne forskning er et svar på dette problem. Det håbes, at denne nye metode kan bidrage til en storstilet implementering af biobrændstofproduktion ved hjælp af mikroalger.
 Varme artikler
Varme artikler
-
 Ny metode inverterer selvsamling af flydende krystallerAktiveringen af en kopformet genstand (halv kugle), der langsomt foldes til en ellipsoide ved opvarmning og vender tilbage til kopform under afkøling. Dette objekt viser også at minimere dets overfl
Ny metode inverterer selvsamling af flydende krystallerAktiveringen af en kopformet genstand (halv kugle), der langsomt foldes til en ellipsoide ved opvarmning og vender tilbage til kopform under afkøling. Dette objekt viser også at minimere dets overfl -
 Dette molekyle er lavet af sukker, formet som en doughnut, og dannet ved hjælp af lysGamma-cyclodextrin er vandopløseligt, donutformet struktur gør det muligt at fange andre molekyler og gør det nyttigt i produktionen af lægemidler, mad, og husholdningsprodukter. Figur af Sirun Yang
Dette molekyle er lavet af sukker, formet som en doughnut, og dannet ved hjælp af lysGamma-cyclodextrin er vandopløseligt, donutformet struktur gør det muligt at fange andre molekyler og gør det nyttigt i produktionen af lægemidler, mad, og husholdningsprodukter. Figur af Sirun Yang -
 Ultra-hvid belægning modelleret på bille-skælCyphochilus bille. Kredit:Olimpia Onelli Forskere har udviklet en supertynd, ikke giftig, letvægts, spiselig ultrahvid belægning, der kunne bruges til at lave lysere maling og belægninger, til bru
Ultra-hvid belægning modelleret på bille-skælCyphochilus bille. Kredit:Olimpia Onelli Forskere har udviklet en supertynd, ikke giftig, letvægts, spiselig ultrahvid belægning, der kunne bruges til at lave lysere maling og belægninger, til bru -
 Ny makrolakton -database kan hjælpe med at opdage lægemidler, forskningKredit:North Carolina State University Forskere fra North Carolina State University og Collaborations Pharmaceuticals har oprettet en gratis database med 14, 000 kendte makrolaktoner - store molek
Ny makrolakton -database kan hjælpe med at opdage lægemidler, forskningKredit:North Carolina State University Forskere fra North Carolina State University og Collaborations Pharmaceuticals har oprettet en gratis database med 14, 000 kendte makrolaktoner - store molek
- Video:Ariane 6 - en realitet i Kourou
- Ny psykologisk model forudsiger, hvem der panikkøber i krisetider
- Eksistentialisme:En ledende filosofi til håndtering af klimaændringer i byer?
- Vigtige internetforbindelser og steder i fare på grund af stigende hav
- Plantetilpasninger i Tundra
- Sådan laver du et skoleprojekt Battlefield Display


