Cellecytoskelet som mål for nye aktive stoffer

Tobias Mühlethaler i PSI-krystallisationsanlægget, udvælgelse af passende krystaller til målingerne Kredit:Paul Scherrer Institute/Mahir Dzambegovic
Gennem en unik kombination af computersimuleringer og laboratorieeksperimenter, forskere ved Paul Scherrer Institute (PSI) har opdaget nye bindingssteder for aktive stoffer - mod cancer, for eksempel - på et vital protein i cellecytoskelettet. Elleve af stederne havde ikke været kendt før. Undersøgelsen vises i dag i tidsskriftet Angewandte Chemie International Edition.
Proteinet tubulin er en væsentlig byggesten i det såkaldte cellecytoskelet. I celler, tubulinmolekyler arrangerer sig selv i rørlignende strukturer, mikrotubulus filamenter. Disse giver celler deres form, hjælpe med at transportere proteiner og større cellulære komponenter, og spiller en afgørende rolle i celledeling.
Tubulin udfører således forskellige funktioner i cellen og interagerer derved med adskillige andre stoffer. "Tubulin kan binde et forbløffende antal forskellige proteiner og små molekyler, sikkert flere hundrede siger Tobias Mühlethaler, en doktorgradskandidat i PSI Laboratory of Biomolecular Research og førsteforfatter af undersøgelsen. Proteinets funktioner styres ved hjælp af sådanne bindinger. Også, mange lægemidler sætter sig fast på tubulin og træder i kraft, for eksempel, ved at forhindre celledeling i tumorer.
"I dette projekt vi behandlede det grundlæggende spørgsmål om, hvor mange bindingssteder der i alt findes på dette vitale protein, " Mühlethaler forklarer. "Hvis vi opdager nye, disse kunne muligvis bruges terapeutisk."
Fra det virtuelle til laboratoriet
I computersimuleringer udført i samarbejde med det italienske teknologiske institut i Genova, forskerne finkæmmede proteinets struktur:De identificerede steder, hvor andre molekyler kunne lægge sig særligt godt til tubulin. Det er de såkaldte bindingslommer. Efterfølgende i et egentligt laboratorieeksperiment, forskerne søgte at verificere sådanne steder. For det, de brugte en metode kaldet fragmentscreening:Startende med hundredvis af krystaller af tubulin, forskerne tilføjede individuelle opløsninger indeholdende fragmenter af molekyler, der er typiske forløbere for lovende aktive stoffer. Inden for en time, tubulinkrystallerne var i stand til at opsuge så meget af fragmentopløsningen, som de kunne rumme. Til sidst blev krystallerne fisket ud af væsken og udsat for synkrotron røntgenstråling. På basis af det resulterende diffraktionsmønster, forskerne er i stand til at udlede krystallens struktur. Det kunne således bestemmes, om og hvor molekylefragmenterne har bundet sig til proteinet.
"Begge metoder, computersimuleringer og fragmentscreening, har deres respektive styrker og svagheder, " siger Michel Steinmetz, leder af Laboratoriet for Biomolekylær Forskning. "Ved at kombinere dem, vi sikrer, at intet bindingssted på proteinet undslipper vores søgning."
Elleve nye
Samlet set, forskerne fandt 27 bindingssteder på tubulin, hvor molekyler eller andre proteiner kan lægge sig fast. "Elleve af dem var aldrig blevet beskrevet før, " siger Mühlethaler. forskerne identificerede 56 fragmenter, der binder til tubulin og kan være egnede til at udvikle nye aktive stoffer.
Som forskerne understreger, deres tilgang kan også overføres til andre proteiner. "Her har vi udviklet en metode til tidlig opdagelse af såkaldte blymolekyler og, med det, nye udgangspunkter for udvikling af aktive stoffer, " siger Michel Steinmetz. Det burde være muligt at anvende denne metode med succes på alle proteiner, for hvilke der kan opnås krystaller af høj kvalitet.
"Søgen efter potentielle nye blymolekyler er et fokus for den schweiziske lyskilde SLS, " Steinmetz tilføjer. "Dette vil få stigende betydning efter opgraderingen til SLS 2.0, planlagt for de kommende år, har fundet sted."
 Varme artikler
Varme artikler
-
 Ny test identificerer giftige svampeSpiselige og giftige svampe indsamlet fra naturen kan være svære at skelne fra hinanden. Kredit:Candace Bever, ARS-USDA En enkel, bærbar test, der kan påvise den dødeligste af svampegiftene på få
Ny test identificerer giftige svampeSpiselige og giftige svampe indsamlet fra naturen kan være svære at skelne fra hinanden. Kredit:Candace Bever, ARS-USDA En enkel, bærbar test, der kan påvise den dødeligste af svampegiftene på få -
 Robotkemiker giver indsigt i livets oprindelseKredit:CC0 Public Domain En robot-evolutionsmaskine, der er i stand til at udforske generationsudviklingen af kemiske blandinger over lange perioder, kunne hjælpe med at kaste nyt lys over livet
Robotkemiker giver indsigt i livets oprindelseKredit:CC0 Public Domain En robot-evolutionsmaskine, der er i stand til at udforske generationsudviklingen af kemiske blandinger over lange perioder, kunne hjælpe med at kaste nyt lys over livet -
 At finde træalternativer til truet ibenholtEn violin med et gribebræt lavet af schweizisk ibenholt. Kredit:Wilhelm Geigenbau AG, Suhr Ligesom mange tropiske træsorter, ibenholt er en truet art, der er vanskelig at bruge, sådan i instrument
At finde træalternativer til truet ibenholtEn violin med et gribebræt lavet af schweizisk ibenholt. Kredit:Wilhelm Geigenbau AG, Suhr Ligesom mange tropiske træsorter, ibenholt er en truet art, der er vanskelig at bruge, sådan i instrument -
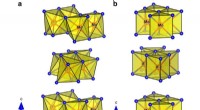 En ny metode til at udvinde brint fra vand mere effektivt for at opfange vedvarende energiKrystalstruktur og {MoTe}6 polyedre, der viser byggestenene i hver polymorf. en monoklinisk 1T′-MoTe2-fase og b hexagonal 2H-MoTe2-fase. Kredit: Naturkommunikation 10.1038/s41467-019-12831-0 En n
En ny metode til at udvinde brint fra vand mere effektivt for at opfange vedvarende energiKrystalstruktur og {MoTe}6 polyedre, der viser byggestenene i hver polymorf. en monoklinisk 1T′-MoTe2-fase og b hexagonal 2H-MoTe2-fase. Kredit: Naturkommunikation 10.1038/s41467-019-12831-0 En n
- Egypten siger, at en gammel kirkegård er fundet ved de berømte pyramider i Giza
- Superhydrofob magnetisk svamp til at hjælpe med at rense vand fra olieprodukter
- Stigende globale temperaturer gør den nordlige permafrostregion til en betydelig kulstofkilde
- Disse fjerne sorte babyhuller ser ud til at opføre sig dårligt - og eksperter er forvirrede
- Test af teorier om samarbejde mellem grupper i landdistrikterne i Georgien
- Studiespor, titel IX-brug på tværs af amerikanske colleges og universiteter


