Bestil fra uorden i sarkomeren
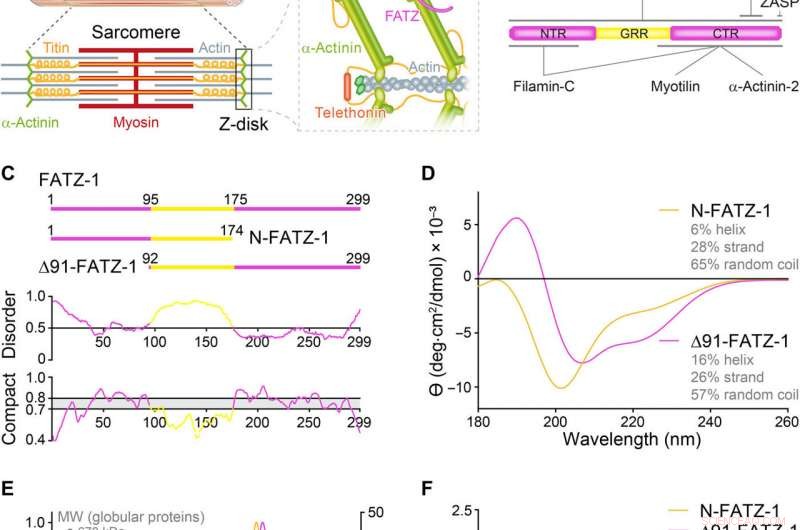
Proteiner fra FATZ-familien viser iboende lidelse. (A) Skema af den tværstribede muskelsarkomer og nærbillede af F-actin/α-actinin/FATZ interaktioner i Z-disk. (B) Skema af FATZ-1-interaktomet og bindingssteder rapporteret til dato. (C) Skema af de vigtigste FATZ-1 konstruktioner, sammen med deres aminosyregrænser og domænesammensætning. Forudsagte uordnede regioner (over 0,5) og kompakthed (over 0,8) er vist nedenfor. (D) Cirkulær dikroisme (CD) spektre af N-FATZ-1 og Δ91-FATZ-1, sammen med beregnet sekundær strukturindhold. (E) Størrelsesudelukkelseskromatografi (SEC) – multiangle light scattering (MALS) analyse af N-FATZ-1 og Δ91-FATZ-1, giver molekylvægte (MW'er) på 21 og 24 kDa, henholdsvis. Elueringsvolumener var lavere end forventet i forhold til globulære standarder [thyroglobulin (670 kDa), y-globulin (158 kDa), ovalbumin (44 kDa), og myoglobin (17 kDa)], svarende til MW'er på 50 og 46 kDa for N-FATZ-1 og Δ91-FATZ-1, henholdsvis. UV, ultraviolet. (F) Dimensionsløse Kratky-plot af N-FATZ-1 og Δ91-FATZ-1, samt af globulært bovint serumalbumin (BSA) (SASBDB-kode SASDFQ8). Eksperimentel SEC – småvinklet røntgenspredningsdata (SAXS) af N-FATZ-1 (G) og Δ91-FATZ-1 (I) og tilsvarende tilpasning til dataene for udvalgte ensembler opnået fra Ensemble Optimization Method (EOM). Rg-fordelinger af udvalgte ensembler i forhold til fordelingen af en tilfældig pulje er vist i indsætningerne. Modelrepræsentanter for de udvalgte EOM-ensembler for N-FATZ-1 (H) og Δ91-FATZ-1 (J), sammen med deres Rg (i nanometer) og volumenfraktioner (i procent). Kredit:Science Advances, doi:10.1126/sciadv.abg7653
Alfa-actinin kan tværbinde actin-filamenter og forankre dem til Z-skiven i sarkomerer. Sarkomerer er en strukturel enhed af myofibril i tværstribede muskler. FATZ (filamin, α-actinin- og telethonin-bindende protein af Z-disk)-proteinet kan interagere med α-actinin og andre kerne Z-disk-proteiner, der bidrager til myofibrill-samling og vedligeholdelse. I en ny rapport nu på Videnskabens fremskridt , Antonio Sponga og et internationalt forskerhold i Østrig, Tyskland, Rusland, Polen og Storbritannien detaljerede den første struktur og cellulære validering af α-actinin-2 komplekset med en Z-disk partner, FATZ-1, at danne et konformt ensemble. FATZ-1 dannede et tæt fuzzy kompleks med α-actinin-2 med en foreslået interaktionsmekanisme via molekylære genkendelseselementer og sekundære bindingssteder. Den opnåede integrative model afslørede en polær arkitektur af komplekset i kombination med FATZ-1 multivalent stilladsfunktionen til at organisere interaktionspartnere og stabilisere.
Sarcomere
De sammentrækkende muskler kan regulere frivillige dyrs bevægelser og ufrivillig hjerteslag, og sarkomerer er de grundlæggende kontraktile enheder af tværstribede muskelceller. De er sammensat af rækker af tynde (aktin) og tykke (myosin) filamenter, der glider forbi hinanden under sammentrækning. Z-skiven kan danne grænsen mellem tilstødende sarkomerer, hvor anti-parallelle actin filamenter er forankret. En passende stabil forankringsstruktur skal genereres af interaktionen mellem myosin og actin. Z-disken kan udfylde denne rolle ved at fungere som et mekanisk nav og en signaleringsplatform for at tillade transmission af spændinger under sammentrækning og varigheden og transmissionen af information om biomekanisk stress. Som resultat, eventuelle mutationer, der forstyrrer Z-diskens arkitektur og funktion, kan risikere at forårsage skelet- og hjertedysfunktion.
Proteinkomplekset
Alpha-actinin er et F-actin tværbindende protein i muskel Z-skiver, som danner en vigtig Z-diskkomponent, der tværbinder antiparallelle actinfilamenter fra tilstødende sarkomerer for at tjene som en bindingsplatform for flere Z-diskproteiner, inklusive FATZ-1. FATZ-proteinerne kan binde til α-actinin gennem deres c-terminale region og til domæner af Enigma-familiemedlemmerne via et specifikt c-terminalt genkendelsesmotiv. I dette arbejde, Antonio Sponga et al. demonstreret, hvordan FATZ-proteiner indeholdt iboende forstyrrede regioner (IDR'er), der bedst beskrives som et konformationelt ensemble, som er mindre stabile og mangler en stabil tertiær struktur. Ud over biofysiske karakteriseringsmetoder, holdet brugte røntgenkrystallografi og småvinklet røntgenstrålespredning til at beskrive et "fuzzy" α-actinin-2/FATZ-1 kompleks. FATZ-1-proteinet kan spille en organisatorisk rolle i Z-skiven på grund af dets multivalente stilladsegenskaber og danne et tæt kompleks af polær arkitektur med α-actinin-2.
FATZ-1 danner et tæt 2:1 kompleks med α-actinin-2 dimer via flere bindingssteder. (A) Skema af a-actinin-2-konstruktionerne, sammen med deres aminosyregrænser og domænesammensætning. SEC-MALS analyse for interaktionen af FATZ-1, FATZ-2, og FATZ-3 med a-actinin-2 (B), N-FATZ-1 med stav-α-actinin-2 (C), Δ91-FATZ-1 med hd-α-actinin-2 (D), og femE A91-FATZ-1 mutant med a-actinin-2 (E). ITC-analyse for interaktionen af Δ91-FATZ-1 med α-actinin-2 (F), N-FATZ-1 med stav-α-actinin-2 (G), Δ91-FATZ-1 med hd-α-actinin-2 (H), og femE A91-FATZ-1 mutant med a-actinin-2 (I). n.d., ikke bestemt. (J) 1H-15N HSQC signalintensitetsforhold på 15N Δ91-FATZ-1 bundet/fri, kortlægning af FATZ-1 primære bindingssted for a-actinin-2. Ikke-tildelt del i FATZ-1 er indpakket, og rester er plottet i en tilfældig position. (K) Sekvens af FATZ-1, der viser flere interaktionssteder for α-actinin-2 som bestemt ud fra peptidarrayet (kvadraterede rester), XL-MS (stjerne), LP-MS (rester afgrænset af pile), og NMR (pile). Rester, der matcher det stærkeste signalpeptid i peptidarrayet, er vist med fed skrift. Grænser for Δ91-FATZ-1 og mini-FATZ-1 er afgrænset af pile. Mutationer inden for femE Δ91-FATZ-1 og RRE Δ91-FATZ-1 er angivet med orange og mørk cyan, henholdsvis. Kredit:Science Advances, doi:10.1126/sciadv.abg7653 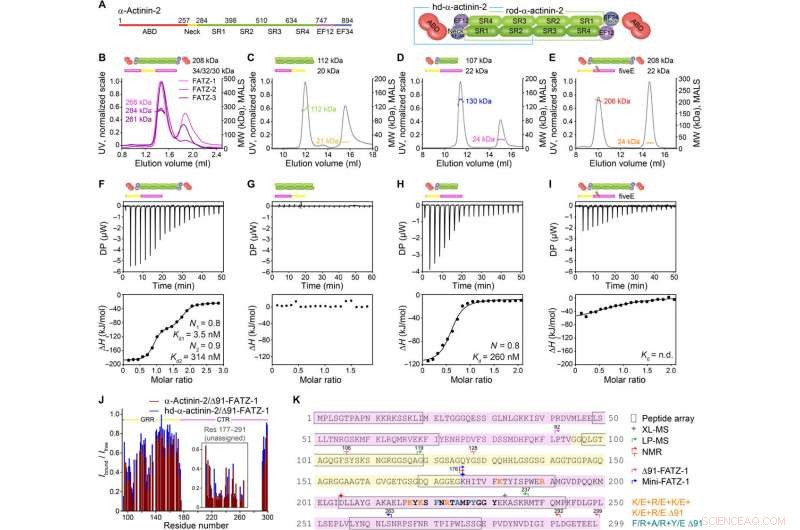
FATZ-proteinfamilien findes på tværs af alle hvirveldyr, hvor human FATZ-1, FATZ-2, og FATZ-3 deler 34 til 40 procent sekvensidentitet. Forskerne genkendte proteolyse-resistente fragmenter, efter at have udført proteolyseforsøg. Når de kombinerede størrelsesudelukkelseskromatografi (SEC) med flervinkellysspredning, de bemærkede de fremherskende monomerer under eksperimentelle betingelser. De karakteriserede derefter monomererne yderligere ved hjælp af SEC kombineret med røntgenspredning med lille vinkel og fremhævede også monomerernes iboende uordnede/ensembletilstande ved hjælp af enkeltkvantekohærens (HSQC) spektre, for begge konstruktioner. For at forstå bindingsstøkiometrien af FATZ-1-til-3-proteinerne til α-actinin-2, Sponga et al. anvendte størrelsesudelukkelseskromatografi-flerkantet lysspredning (SEC-MALS). For at karakterisere bindingsstøkiometrien af FATZ-1-til-3-proteinerne til α-actinin-2, Sponga et al. brugte SEC-MALS. Resultatet viste, hvordan hver af de tre FATZ-proteiner dannede et tæt kompleks med α-actinin-2, med en bindingsstøkiometri på to FATZ-molekyler pr. a-actinin-2-dimer. Det er et FATZ-molekyle pr. a-actinin-2-underenhed. Holdet brugte derefter isotermisk titreringskalorimetri (ITC) til at kvantificere interaktionsaffiniteten.
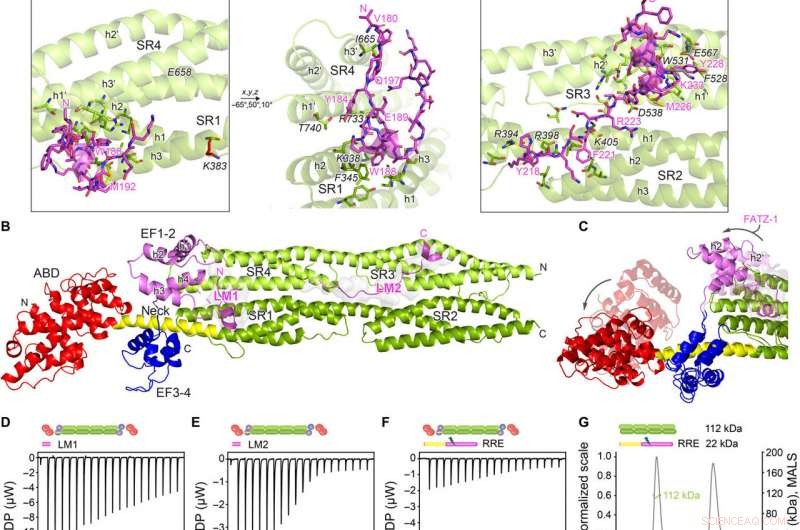
Krystalstrukturer af α-actinin-2/FATZ-1 afslører to lineære bindingsmotiver i FATZ-1. (A) Krystalstruktur af stav-α-actinin-2/mini-FATZ-1 (i grøn/magenta), sammen med den bestemte FATZ-1-konsensussekvens (35 til 80 % og 60 til 84 % parvis sekvensidentitet for LM1 og LM2, henholdsvis). Tværbundne rester er angivet med blå, rød, og grå stjerner/kugler/pinde på rækkefølgen/strukturen. Identificerede Se-Mets er vist med gult. Staven-α-actinin-2-dimeren samles gennem en krystallografisk todelt akse mellem symmetripartnere (sort cirkel). Interagerende rester (stav-α-actinin-2 i kursiv), sammen med helixer fra SR1/SR2 (h1, h2, og h3) og SR3/SR4 (h1′, h2′, og h3′), vises i nærbilleder. (B) Krystalstruktur af hd-α-actinin-2/Δ91-FATZ-1 (LM1 og LM2 som magenta tegneserie og transparent grå overflade; hd-α-actinin-2 farvekodet som i fig. 2A). (C) Sammenligning af ubundet [Protein Data Bank (PDB) kode 4D1E] og bundet (dette arbejde) hd-α-actinin-2. ABD og EF1-2 af ubundet hd-a-actinin-2 er vist med gennemsigtighed. ITC-analyse for interaktionen af LM1-peptid med α-actinin-2 (D), LM2-peptid med α-actinin-2 (E), og RRE A91-FATZ-1 mutant med a-actinin-2 (F). SEC-MALS analyse for interaktionen af RRE Δ91-FATZ-1 mutant med stav-α-actinin-2 (G) og Δ91-FATZ-1 med E. histolytica stav-α-actinin-2 (H). Kredit:Science Advances, doi:10.1126/sciadv.abg7653
Flere bindingssteder for proteinkomplekset
Holdet bemærkede, hvordan FATZ-1 interagerede med α-actinin-2 via flere bindingssteder. For at indsnævre FATZ-1-bindingsstederne, Sponga et al. brugt begrænset proteolyse og kemisk tværbinding koblet med massespektrometri på proteinkomplekset. For derefter at hjælpe med krystalliseringen af dette proteinkompleks, holdet kombinerede derefter også informationen fra peptid-arrayet og genererede en kortere konstruktion kendt som mini-FATZ-1 til yderligere undersøgelser af deres strukturelle biologi. Forskerne validerede derefter de uklare modeller udviklet i arbejdet ved hjælp af beregnet og eksperimentelt afledt indre viskositet - en hydrodynamisk parameter for proteinkonformation. For derefter at forstå bidraget af α-actinin-2 til at lokalisere FATZ-proteiner på Z-disken af sarcomeren, Sponga et al. transficerede GFP-mærkede FATZ-1- eller FATZ-2-proteiner til udødeliggjorte musemyoblaster eller neonatale rottekardiomyocytter. Både FATZ-1- og -2-proteiner målrettede korrekt mod Z-disken og co-lokaliserede med α-actinin-2.
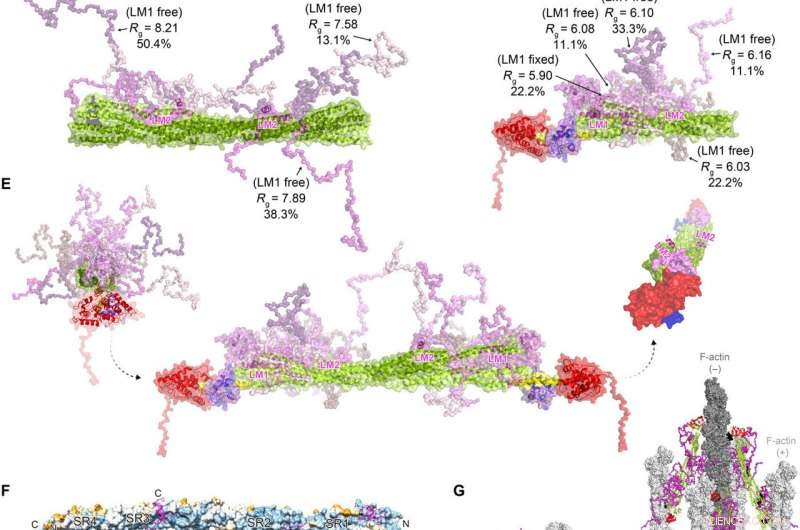
FATZ-1 danner et fuzzy kompleks med α-actinin-2, hvilket resulterer i en polær arkitektur af komplekset. Eksperimentelle SAXS-data for stav-α-actinin-2/Δ91-FATZ-1 (A) og hd-α-actinin-2/Δ91-FATZ-1 (B), med den tilsvarende model passer til dataene for de valgte ensembler. GAJOE, Genetisk algoritmevurdering Optimering af ensembler. Fleksible områder af Δ91-FATZ-1, usynlige i vores bestemte krystalstrukturer, blev genereret med EOM, der holdt LM1 enten fast eller fri (10, 000 modeller for hver). Udvalgte ensemblemodelrepræsentanter for stav-α-actinin-2/Δ91-FATZ-1 (C) og hd-α-actinin-2/Δ91-FATZ-1 (D) , sammen med deres Rg- og volumenfraktioner i ensemblet. (E) Integrativ model af fuzzy α-actinin-2/Δ91-FATZ-1 bygget ved hjælp af røntgenkrystallografi og SAXS-modeller af hd-α-actinin-2/Δ91-FATZ-1. Rotation for LM2-helixer af bundne FATZ-1-molekyler i forhold til hinanden, samt torsionsdrejning i stangen langs den langsgående α-actinin-2 akse, er vist i det højre indlæg (FATZ-1 fleksible dele er udeladt for overskuelighedens skyld). (F) Overflade af stav-a-actinin-2/FATZ-1-strukturen, der viser sekvenskonserveringen af a-actinin-interagerende rester for FATZ-1 (justering udført ved anvendelse af 1505 a-actininer fra hvirveldyr). (G) Model af F-actin/α-actinin-2/FATZ-1 (F-actin i lys og mørkegrå) baseret på en kryo-elektrontomografistruktur af Z-disken og den integrerende model. Kredit:Science Advances, doi:10.1126/sciadv.abg7653
Outlook
På denne måde Antonio Sponga og kolleger beskrev, hvordan sarkomersamlingen startede fra Z-legemer af α-actinin-2, at inkludere proteiner såsom FATZ, myotilin, og aktin, for at nævne et par stykker. Resultatet indikerer, at proteiner fra FATZ-familien er tilgængelige i Z-legemer og modne Z-diske med en rolle i proteinsignaleringsveje til at binde calcineurin. Holdet fremhævede rollen som FATZ-1, det mest undersøgte familiemedlem og dets interaktion med det store Z-diskprotein α-actinin-2. Strukturen og bindingsmekanismen af det fuzzy α-actinin-2/FATZ-1 kompleks understøttet FATZ-1 fungerer som et klassisk stilladsprotein i Z-diskenheden. Yderligere undersøgelser vil afsløre, om de samme principper gælder under fysiologiske forhold i levende celler.
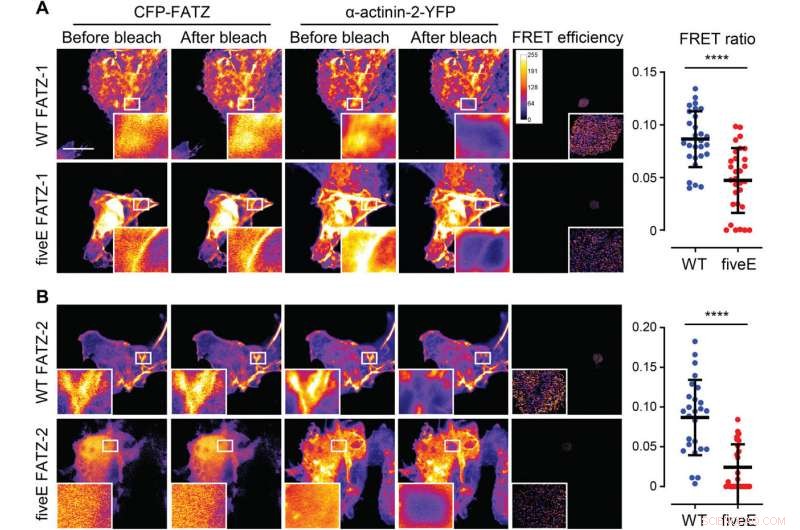
α-Actinin-2 stabiliserer FATZ-proteiner ved Z-disken. (A) COS-1-celler, der samtidig udtrykker forstærket CFP (ECFP)-mærket FATZ-1 (WT FATZ-1) eller tilsvarende femE-mutant, i kombination med actinin-2-EYFP, som bestemt i fikserede celler ved acceptorfotoblegning. Repræsentative billeder er vist før og efter blegning for begge proteiner. Blegede områder af interesse er vist (indskud), sammen med FRET-effektiviteter brugt til at beregne FRET-forhold præsenteret i den tilstødende graf [n =28 (WT) og 30 (fiveE), ****P <0,0005, Elevens t-test). (B) Samme celler som i (A), men samtidig udtryk for ECFP-mærkede FATZ-2-varianter i kombination med EYFP-α-actinin-2 [n =26 (WT) og 25 (fiveE), ****P <0,0005, Elevens t-test). Skala barer, 10 μm på alle billeder. Kredit:Science Advances, doi:10.1126/sciadv.abg7653
© 2021 Science X Network
 Varme artikler
Varme artikler
-
 Seneste fund om bitterstoffer i kaffeModel af den bitre receptor TAS2R43 uden ekstracellulært domæne. I bindingslommen:Model af bitterstoffet mozambiosid (blå). Kredit:Leibniz-LSB@TUM; Dr. Antonella Di Pizio Kaffe er meget populær ov
Seneste fund om bitterstoffer i kaffeModel af den bitre receptor TAS2R43 uden ekstracellulært domæne. I bindingslommen:Model af bitterstoffet mozambiosid (blå). Kredit:Leibniz-LSB@TUM; Dr. Antonella Di Pizio Kaffe er meget populær ov -
 Ny metode til at kopiere barske forhold for materialerKredit:Chris Bolin, Wikimedia Commons Indeslutning af en plasmastråle kan være stress-inducerende, især på afskærmningsmaterialerne. Bemærk de begrænsninger, der ligger i de testmetoder, der i øje
Ny metode til at kopiere barske forhold for materialerKredit:Chris Bolin, Wikimedia Commons Indeslutning af en plasmastråle kan være stress-inducerende, især på afskærmningsmaterialerne. Bemærk de begrænsninger, der ligger i de testmetoder, der i øje -
 Indstilling af en TRAP for pandemi-fremkaldende viraTRAP-visningsmetoden fisker efter syntetiske proteiner fra et bibliotek af billioner efter dem, der kan målrette mod SARS-CoV-2. Tilgangen var i stand til at identificere proteiner, der kan bruges til
Indstilling af en TRAP for pandemi-fremkaldende viraTRAP-visningsmetoden fisker efter syntetiske proteiner fra et bibliotek af billioner efter dem, der kan målrette mod SARS-CoV-2. Tilgangen var i stand til at identificere proteiner, der kan bruges til -
 Lad det regne! Nye belægninger gør naturlige stoffer vandtætteAfvisning af forskellige væsker på polyesterstof belagt med H1F7Ma-co-DVB:sojasovs (sort dråbe), kaffe (brun dråbe), HCl -syre (øverste venstre gennemsigtige dråbe), NaOH (gennemsigtig dråbe nederst t
Lad det regne! Nye belægninger gør naturlige stoffer vandtætteAfvisning af forskellige væsker på polyesterstof belagt med H1F7Ma-co-DVB:sojasovs (sort dråbe), kaffe (brun dråbe), HCl -syre (øverste venstre gennemsigtige dråbe), NaOH (gennemsigtig dråbe nederst t
- Buckyballs forbedrer kulstoffangst:Miljøvenligt materiale er rettet mod røggasser, brønde
- NIST-teamet demonstrerer hjertet af næste generation af atomur i chipskala
- Sådan beregnes batteri watt-timer
- Hvordan kvante Zeno -effekten påvirker Schroedingers kat
- Naturligt silica-baseret pesticid beskytter afgrøder i opbevaring og kan fjerne giftig fosfin
- En film om mikroverdenen:Fysikere skaber nanopartikel billedserier


