Neutroner fanger formskiftende coronavirus-proteinkompleks på akten
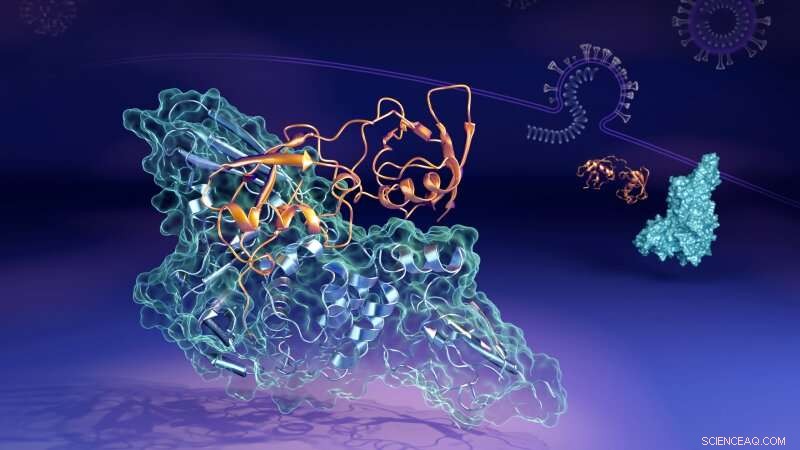
Kredit:Oak Ridge National Laboratory
Mens alle vira har nogle midler til at bekæmpe kroppens immunsystem, forskere har undersøgt, hvordan SARS-CoV-2-coronavirus - årsagen til den globale COVID-19-pandemi - kan unddrage sig immunsystemet hos mennesker.
Nu har forskere, der arbejder ved det amerikanske energiministeriums (DOE's) Oak Ridge National Laboratory (ORNL) afsløret de molekylære detaljer om, hvordan et nøgleprotein (den papain-lignende protease, eller "PLpro") fra virusforbindelserne til at danne en parret struktur, eller "komplekst, " med et humant protein ved navn interferon-stimuleret gen 15 (ISG15). PLpro stripper ISG15 fra andre humane cellulære proteiner for at hjælpe SARS-CoV-2 med at undgå immunresponset. Forståelse af, hvordan de to proteiner interagerer, kan hjælpe med at udvikle terapeutiske lægemiddelbehandlinger, der forhindre dets dannelse og tillade en persons immunsystem bedre at bekæmpe den invaderende virus.
Forskningsresultaterne, med titlen "Conformational Dynamics in the Interaction of SARS-CoV-2 Papain Like Protease with Human Interferon-Stimulated Gene 15 Protein, " blev offentliggjort i Journal of Physical Chemistry Letters .
"I menneskelige celler, som virussen har inficeret, PLpro fra SARS-CoV-2-virus har en tendens til at opsøge og binde med ISG15-proteinet, en nøglekomponent i cellernes immunrespons, " sagde Hugh O'Neill, leder af ORNL's Bio-Facilities-gruppe og direktør for laboratoriets Center for Strukturel Molekylær Biologi. "Når PLpro binder til ISG15, det får ISG15 til at ændre form. Nøgleresultatet er, at ISG15 kan antage flere former, når den binder til PLpro."
Ved hjælp af small-angle neutron scattering (SANS) ved ORNL's High Flux Isotope Reactor (HFIR), forskerne var i stand til at studere ændringerne i komplekset, mens de fandt sted.
"Vi forbedrede kontrasten mellem PLpro og ISG15 ved at forberede PLpro, hvor mange af brintatomerne blev erstattet med deuteriumatomer, sagde Kevin Weiss, en ekspert i bio-deuteration. "Neutroner interagerer forskelligt med deuteriumatomer, så dette hjalp os bedre med at skelne mellem de to proteiner.
"Vi brugte neutroner til at analysere komplekset i opløsning, som bedre simulerer det faktiske fysiologiske miljø i den menneskelige krop, " sagde Leighton Coates, instrument systemer videnskab og teknologi leder for ORNL's Second Target Station. "Dette gav os mulighed for at studere kompleksets skiftende former, som andre teknikker ikke kunne have opfanget."
"De oplysninger, vi har fået fra vores eksperimenter, øger vores viden om, hvordan virussen virker og vil gøre os i stand til at bygge mere nøjagtige computermodeller, som andre forskere kan bruge, " sagde Wellington Leite, hovedforfatter og ORNL postdoc-forsker. "Forskere vil være i stand til at bruge modellen til hurtigt at søge efter websteder på ISG15, hvor PLpro'en vedhæfter, og derefter prøve at blokere disse websteder."
Susan Tsutakawa, en biokemikerstabsforsker ved Lawrence Berkeley National Laboratory (Berkeley Lab), opnåede småvinklede røntgenspredningsdata (SAXS) på PLpro-ISG15-komplekset ved Berkeley Labs Advanced Light Source Synchrotron. "I SAXS-studierne, vi kunne adskille forskellige komplekser i prøven ved at koble SAXS med størrelsesudelukkelseskromatografi og på samme tid, få data med højere opløsning af kompleksets overordnede konfiguration, at supplere SANS-undersøgelserne, der afslørede konformationerne af individuelle komponenter i komplekset, " sagde Tsutakawa.
Holdet planlægger at udføre yderligere eksperimenter på denne type biologisk kompleks for at undersøge, hvordan små molekyler kan blokere bindingen af PLpro til ISG15.
 Varme artikler
Varme artikler
-
 Video:Heltinder i det periodiske systemKredit:The American Chemical Society I 1871, Dimitri Mendeleev præsenterede sit periodiske system for verden. Mange af de nuværende 118 elementer manglede, og han efterlod pladsholdere til dem, de
Video:Heltinder i det periodiske systemKredit:The American Chemical Society I 1871, Dimitri Mendeleev præsenterede sit periodiske system for verden. Mange af de nuværende 118 elementer manglede, og han efterlod pladsholdere til dem, de -
 Grundlæggende opdagelser for fremtidige nanoværktøjer:Kemikere skelner mellem flere svage kræfte…Fold din egen nanocube! Selvom nanokuberne brugt i forskningsprojektet bygger sig selv, du kan folde din egen ved hjælp af denne model. Hver gul X repræsenterer steder, hvor forskere ved University of
Grundlæggende opdagelser for fremtidige nanoværktøjer:Kemikere skelner mellem flere svage kræfte…Fold din egen nanocube! Selvom nanokuberne brugt i forskningsprojektet bygger sig selv, du kan folde din egen ved hjælp af denne model. Hver gul X repræsenterer steder, hvor forskere ved University of -
 Model forudsiger polymer mademballager tilbøjelighed til at absorbere aromamolekyler fra deres indh…Kredit:CC0 Public Domain Dine yndlingsfødevarer og drikkevarer vil snart kunne smage endnu bedre, takket være nye beregninger udviklet på A*STAR. En væsentlig kilde til tab af smag til mad og drik
Model forudsiger polymer mademballager tilbøjelighed til at absorbere aromamolekyler fra deres indh…Kredit:CC0 Public Domain Dine yndlingsfødevarer og drikkevarer vil snart kunne smage endnu bedre, takket være nye beregninger udviklet på A*STAR. En væsentlig kilde til tab af smag til mad og drik -
 Denne RNA-baserede teknik kunne gøre genterapi mere effektivKredit:CC0 Public Domain Levering af funktionelle gener til celler for at erstatte muterede gener, en metode kendt som genterapi, har potentiale til behandling af mange former for sygdomme. De tid
Denne RNA-baserede teknik kunne gøre genterapi mere effektivKredit:CC0 Public Domain Levering af funktionelle gener til celler for at erstatte muterede gener, en metode kendt som genterapi, har potentiale til behandling af mange former for sygdomme. De tid
- Gennembrud i actinid metal-metal binding
- Græshopper på farten gør migrerende stop i Vegas-området
- Farlige materialer i sunket fragtskib ud for Frankrig:myndigheder
- Svovl i hule nanofibre overvinder udfordringer ved lithium-ion batteridesign
- NASA finder, at en dårligt defineret Tropical Depression 15W bliver organiseret
- Naturafledte peptider som molekylære værktøjer til at studere cellulær signalering


