Sådan beregnes frysepunktet
Ved antagelse af standardtryk i en atmosfære er frysepunkt den temperatur, hvorved en væske kondenserer til et faststof. Nogle gasser, såsom carbondioxid, kan blive faste stoffer uden at gå gennem en flydende fase via en proces kaldet sublimering. Alle væsker og gasser, med undtagelse af helium, har karakteristiske frysepunkter, som forskere har opdaget gennem eksperimentering, ikke beregning. En generel formel, der er kendt som Blagdens lov, giver dig dog mulighed for at beregne, hvordan tilsætningen af et opløst stof vil sænke et opløsningsmidlets frysepunkt i direkte forhold til opløsningens koncentration.
Slå op i en mols masse af opløst stof. En mol er et bestemt antal partikler - ioner, atomer eller molekyler - i et stof. Det specifikke tal er Avogadros konstant, 6,02 x 10 ^ 23. Du kan opsøge massen af en mol af det opløste stof på internettet eller i en kemi lærebog. For eksempel er massen af en mol natriumchlorid eller bordsalt 58,44 gram /mol.
Undersøg opløsningsmidlets egenskaber. For eksempel kan du opsøge H20 eller vand på forskellige hjemmesider og finde ud af, at dets frysepunkt er nul grader Celsius. Vand har en anden egenskab, kaldet dets kryoskopiske indhold ("Kf") svarende til 1,86 i enheder af (grader Celsius x kg /mol). Kf for et opløsningsmiddel beskriver, hvor meget dets frysepunkt vil falde ved tilsætning af et opløst stof.
Bestem molaliteten ("m") af opløsningen, som defineres som antallet af mol opløst stof pr. Kg af opløsningsmiddel. Hvis du for eksempel tilføjer 58,44 gram natriumchlorid til et kilo vand - hvilket også er en liter vand - har du en saltvandsløsning med en molalitet af en mol salt /et kilo vand eller en mol /kilogram.
Søg efter van't Hoff-faktoren ("jeg") for opløsen. Dette er forholdet mellem mol af opløst stof før og efter det er opløst. For eksempel dissocierer en mol natriumchlorid i vand for at danne en mol hver af natrium- og chlorioner. Derfor har bordsalt en van't Hoff faktor på to.
Beregn depression af frysepunktet ved hjælp af formlen Tf = (ix Kf xm), hvor Tf er hvor meget frysepunktet falder i grader Celsius. I vores eksempel, Tf = (2 x 1,86 x 1) eller 3,72 grader C, faldt frysepunktet vand fra nul til negativ 3,72 grader C.
TL; DR (for lang tid, ikke læst )
Faldet i frysepunktet afhænger kun af opløsningsmidlet, ikke opløsningsmidlet. Dette gælder for fortyndede løsninger, men meget koncentrerede løsninger kræver en kompleks beregning til bestemmelse af frysepunktsdepression.
Advarsel
Forveksl ikke molalitet med udtrykket "molaritet", hvilket er tallet af mol opløst del divideret med opløsningens volumen.
Sidste artikelSjov kemi eksperimenter for High Schools
Næste artikelTyper af gas svejsning
 Varme artikler
Varme artikler
-
 Fire måder at fremskynde en kemisk reaktionEn kemisk reaktion opstår, når molekylerne af reaktanterne kolliderer med hinanden i det reagerende miljø. Den hastighed, hvormed en reaktion finder sted, afhænger af hastigheden for molekylernes k
Fire måder at fremskynde en kemisk reaktionEn kemisk reaktion opstår, når molekylerne af reaktanterne kolliderer med hinanden i det reagerende miljø. Den hastighed, hvormed en reaktion finder sted, afhænger af hastigheden for molekylernes k -
 Lighederne mellem stivelse og glycogenNår du tænker på stivelse, tænker du sandsynligvis først på mad, og der er en god grund til det. Mange af dine vigtigste plantemad, som majs og kartofler, er rige på stivelse. Faktisk produceres stive
Lighederne mellem stivelse og glycogenNår du tænker på stivelse, tænker du sandsynligvis først på mad, og der er en god grund til det. Mange af dine vigtigste plantemad, som majs og kartofler, er rige på stivelse. Faktisk produceres stive -
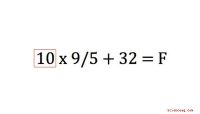 Sådan konverteres Celsius til FahrenheitTrods den metriske konverteringslov fra 1975 forbliver USA et af de få lande, der stadig bruger Fahrenheit-temperaturskalaen. Forskere overalt, herunder i USA, arbejder dog med Celsius temperatur skal
Sådan konverteres Celsius til FahrenheitTrods den metriske konverteringslov fra 1975 forbliver USA et af de få lande, der stadig bruger Fahrenheit-temperaturskalaen. Forskere overalt, herunder i USA, arbejder dog med Celsius temperatur skal -
 Fejl i titreringseksperimenterTitrering er en følsom analysemetode, der giver dig mulighed for at bestemme en ukendt koncentration af et kemikalie i opløsning ved at introducere en kendt koncentration af et andet kemikalie. Flere
Fejl i titreringseksperimenterTitrering er en følsom analysemetode, der giver dig mulighed for at bestemme en ukendt koncentration af et kemikalie i opløsning ved at introducere en kendt koncentration af et andet kemikalie. Flere


