Ny strategi til præcist at målrette undertyper af nøgleprotein
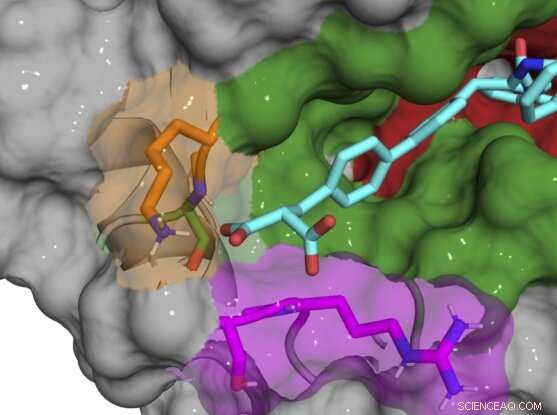
Røntgen-co-krystalstruktur af B52-forbindelse (cyan), der binder og hæmmer cyclophilin D-protein. Kredit:Aziz Rangwala
Cyclosporin er et af de mest almindelige og effektive immunsuppressive lægemidler, der bruges til at behandle kroniske sygdomme som gigt og psoriasis, men det kommer med en risiko for alvorlige bivirkninger. Forskere mener, at det kan skyldes, at stoffet bredt er rettet mod cyclophiliner, en familie af 17 regulatoriske proteiner, der spiller forskellige roller i at fremme cellulær sundhed. Selvom hver enkelt cyclophilin-undertype har en unik rolle, er mange nuværende immunsuppressive lægemidler rettet mod hele familien, hvilket betyder, at vigtige ukendte veje ved et uheld kan blive slukket eller på anden måde ændret.
Problemet kompliceres af det faktum, at det aktive sted, hvor molekyler binder, er næsten identisk på tværs af alle 17 cyclophiliner, hvilket gør det svært for lægemiddelproducenter at målrette mod specifikke undertyper. I et papir offentliggjort i dag i Nature Chemical Biology , forskere i laboratoriet hos Broad Institute Core Member David Liu, som også er direktør for Merkin Institute of Transformative Technologies in Healthcare på Broad, i samarbejde med laboratorierne for Markus Seeliger på SUNY Stony Brook og institutmedlem Vamsi Mootha ved Massachusetts General Hospitalet har foreslået en ny løsning.
I stedet for at målrette det aktive sted af cyclophilin-proteiner, beskriver forskere i Lius laboratorium en proces, der finder forbindelser, der binder til "exo-stedet", en lille lomme ved siden af det aktive sted, der varierer i størrelse og form på tværs af forskellige cyclophiliner. Ved at bruge isolerede proteiner i et reagensglas opdagede holdet flere forbindelser, der udelukkende binder og hæmmer Cyclophilin D (CypD), et protein involveret i åbning og lukning af mitokondrielle porer. De anvendte også lignende principper for at opdage unikke, selektive inhibitorer for Cyclophilin E (CypE). Forfatterne siger, at deres undersøgelse danner grundlaget for, at forskere kan udvikle yderligere subtype-selektive cyclophilin-hæmmere, hvoraf nogle kan være nyttige som værktøjer til biologi eller som leads til terapeutisk udvikling.
"Det er en ny bindingstilstand, der udnytter en lomme, som folk ikke helt har udforsket endnu," sagde hovedforfatter Alex Peterson, nu postdoc ved Scripps Research Institute, der ledede projektet som kandidatstuderende i Lius laboratorium. . "Det er en slags plan for, hvordan folk kan designe selektive cyclophilin-hæmmere fremadrettet."
Udnyttelse af nye og gamle teknologier
CypD regulerer den mitokondrielle permeabilitetsovergangspore (mPTP), små porer placeret på den indre overflade af mitokondrier (berømt kendt som cellens kraftcenter). Når CypD registrerer oxidativt stress eller høje calciumniveauer, skynder det sig at åbne mPTP'en, hvilket tillader vand og andre ioner at strømme ind og ud af mitokondrierne.
Denne åbning af mitokondrielle sluser kan blive et problem med sygdomme som iskæmisk reperfusionsskade, diabetes, neurodegenerative lidelser, leversygdomme og mere. Da disse tilstande kan forårsage unormalt høje niveauer af oxidativ stress, holder CypD mitokondrieporerne åbne i længere tid end normalt, hvilket forårsager mitokondriel dysfunktion, brud og celledød. Man har troet, at lægemidler, der bremser og hæmmer CypD's reaktion på højt oxidativt stress, kan bruges til at behandle en lang række sygdomme.
For at spore forbindelser, der udelukkende binder til CypD, henvendte holdet sig til DNA-kodede småmolekylebiblioteker, en teknologi udviklet for over tyve år siden som et af de første projekter i Lius dengang nye laboratorium. Forskere kan bruge bibliotekerne, som er fyldt med hundredtusindvis af syntetiske forbindelser knyttet til unikke DNA-stregkoder, til at scanne for molekyler, der binder til ønskede proteiner. Ved at blande isolerede CypD-proteiner og en samling af 256.000 unikke DNA-kodede forbindelser i et reagensglas identificerede holdet hundredvis af lovende forbindelser.
De fleste af de oprindelige forbindelser er stadig bundet i og omkring det aktive sted, og hæmmer flere cyclophilin-subtyper, så holdet foretog gradvist små kemiske ændringer i deres forbindelser for at gøre dem unikke for CypD. Da de opdagede, at exo-stedet var nøglen til at udvikle subtype-specifikke inhibitorer, var de i stand til at designe et par forbindelser, der potent hæmmer CypD, mens de minimalt påvirker andre cyclophiliner. Røntgen-co-krystalstrukturer af CypD-proteinet og inhibitorerne under udvikling gav holdet et kig bag kulisserne på det præcise sted, hvor deres molekyler blev bindende.
Forskerne behandlede derefter isolerede mitokondrier med deres to førende forbindelser og observerede, at de var effektive til at bremse CypD's åbning af mitokondrielle porer. Spejlbillederne af deres forbindelser, som ikke hæmmer CypD, viste ikke aktivitet i mitokondrier. For at bevise, at deres succes ikke var en isoleret hændelse, gentog de strategien igen for CypE, en cyclophilin, der er ansvarlig for at regulere mRNA-behandling. Endnu en gang udviklede de en forbindelse, der udelukkende målrettede den og efterlod de resterende 16 cyclophiliner ufasede.
Holdet håber, at deres resultater i sidste ende kan hjælpe kemiske biologer og lægemiddelproducenter med at bygge bedre og mere specifikke cyclophilin-målrettede lægemidler. De gav endda fremtidige videnskabsmænd et ben – fordi de CypD-målrettede forbindelser kæmper for at trænge ind i menneskelige celler på egen hånd, tilpassede holdet dem ved at tilføje esterderivater, der effektivt omgår plasmamembranen og leverer til mitokondrier.
"Vores teams arbejde tillod os til sidst at overvinde dette langvarige problem:hvordan hæmmer man selektivt kun én cyclophilin-undertype ud af 17?" sagde Liu, som også er efterforsker ved Howard Hughes Medical Institute. "I fremtiden vil molekyler, der kommer fra at bruge vores strategi, forhåbentlig vise sig at være nyttige både for grundlæggende videnskab og potentielt til terapi." + Udforsk yderligere
Ny syntesestrategi fremskynder identifikation af enklere versioner af et naturprodukt
 Varme artikler
Varme artikler
-
 Nyopdagede hybridmolekyler kunne tjene som en ny kategori af anti-cancermiddelEn skematisk fremstilling af virkningsmekanismen for de metalorganiske trefoil-knuder. Internaliseret via aktiv mekanisme, i det sure miljø af kræftceller, knuderne falder fra hinanden og udløser toks
Nyopdagede hybridmolekyler kunne tjene som en ny kategori af anti-cancermiddelEn skematisk fremstilling af virkningsmekanismen for de metalorganiske trefoil-knuder. Internaliseret via aktiv mekanisme, i det sure miljø af kræftceller, knuderne falder fra hinanden og udløser toks -
 Forskere udtænker en billigere og hurtigere måde at kontinuerligt producere aminer påForskere ved North Carolina State University har udviklet en hurtigere og billigere teknik til fremstilling af hindrede aminer - en klasse af kemikalier, der bruges som byggesten i produkter lige fra
Forskere udtænker en billigere og hurtigere måde at kontinuerligt producere aminer påForskere ved North Carolina State University har udviklet en hurtigere og billigere teknik til fremstilling af hindrede aminer - en klasse af kemikalier, der bruges som byggesten i produkter lige fra -
 Temperatursensor kan hjælpe med at beskytte mRNA-vaccinerNår temperaturen på et hætteglas med simuleret vaccine stiger over -60 C i mere end 2 minutter, et blåt farvestof i et tilstødende rør diffunderer ind i en hvid absorbent, efterlader et irreversibelt
Temperatursensor kan hjælpe med at beskytte mRNA-vaccinerNår temperaturen på et hætteglas med simuleret vaccine stiger over -60 C i mere end 2 minutter, et blåt farvestof i et tilstødende rør diffunderer ind i en hvid absorbent, efterlader et irreversibelt -
 Nye materialer med vigtige anvendelser i forbedret oliegenvindingForskelle i bevægelsen af olie gennem mikrokanalerne ved tilsætning af overfladeaktivt stof i nærvær af silicananopartikler sammenlignet med det overfladeaktive middel alene, hvilket viser, hvordan
Nye materialer med vigtige anvendelser i forbedret oliegenvindingForskelle i bevægelsen af olie gennem mikrokanalerne ved tilsætning af overfladeaktivt stof i nærvær af silicananopartikler sammenlignet med det overfladeaktive middel alene, hvilket viser, hvordan
- Forskere registrerer brede spektre med tæt på hundrede tusinde farver i næsten fuldstændigt mør…
- Hvordan er der dannet rosenkvarts?
- Forskere finder ingen sammenhæng mellem brug af sociale medier og skolens præstationer
- Covid-19-nedlukninger påvirkede sorte lavindkomsthusholdninger uforholdsmæssigt meget
- Seks ting at vide om NASAs Ingenuity Mars-helikopter
- El Niño påvirker nedbørsgenanvendelsesforholdet over det tibetanske plateau på en årlig tidsska…


