Undersøgelse af bedre biotransformationer

Madagaskar periwinkle. Kredit:Wikimedia Commons, CC BY-SA
Forskning i International Journal of Bioinformatics Research and Applications har undersøgt kemien og opførselen af et nyttigt naturprodukt fremstillet af Madagaskar-periwinkle (Catharanthus roseus Bunge). Arbejdet kunne udvide repertoiret af et voksende område af kemisk videnskab - biotransformation - hvor naturens molekylære maskineri bruges til at bygge og ændre nye forbindelser i laboratoriet.
Mange naturlige produkter, per definition kemiske forbindelser fremstillet af levende organismer, har fysiologisk aktivitet og er blevet isoleret fra deres kilde og undersøgt og udviklet til farmaceutiske produkter. Faktisk har cirka to ud af fem receptpligtige lægemidler oprindelse i naturlige produkter. Almindeligvis er det aktive kemikalie i en levende organisme dog modificeret til et bestemt formål eller lægemiddelprofil med anderledes, mere målrettet aktivitet i en sygdom og f.eks. færre eller mindre skadelige bivirkninger. Derudover er modificering af et naturprodukt ofte en forudsætning for at gøre et nyt lægemiddel tilstrækkeligt anderledes til, at der kan indgives en vellykket patentansøgning og et lægemiddel bringes på markedet rentabelt.
I de sidste par årtier har kemikere fundet måder at bruge enzymer til at modificere naturlige produkter, og til gengæld har de fundet måder at modificere enzymer for at få dem til at arbejde anderledes og give dem mulighed for at behandle naturlige produkter og andre molekyler på forskellige måder for at generere hidtil usete molekyler. mangfoldighed. Et hvilket som helst af disse enorme antal af nye molekyler kunne have fysiologisk aktivitet, der kan være nyttig til behandling af bestemte sygdomme og lidelser.
Piotr Szymczyk, Grażyna Szymańska, Małgorzata Majewska, Izabela Weremczuk-Jeżyna, Michał Kołodziejczyk, Kamila Czarnecka, Paweł Szymański og Ewa Kochan fra Medical University of Łódź, har investeret i en del af naturens maskiner, Polen, i en molekylær maskine, Polen C. roseus strictosidin β-D-glucosidase. Enzymer er proteiner, der virker på små molekyler, deres substrater, og omdanner dette substrat til et andet molekyle, der bruges af den levende organisme. Holdet rapporterer strukturen af dette enzym fra periwinkle med fokus på lommen i dets molekylære struktur, der binder til substratet, enzymets aktive sted.
Holdet byggede en computermodel af periwinkle-enzymet ved hjælp af Discovery Studio 4.1-software og en skabelon for enzymet baseret på et andet kendt enzym fra en β-glucosidase fundet i ris, som de modificerede for at matche de kendte detaljer for periwinkle-enzymet. De kunne derefter bruge et andet computerprogram - en algoritme kaldet CDOCKER - for at se, hvordan forskellige kemiske substrater ville interagere med det aktive sted for modelperiwinkle-enzymet. De testede det naturlige substrat, et molekyle kendt som strictosidin og en anden kemisk D-glucono 1,5-lacton. Dette sidstnævnte molekyle er kendt for at binde til enzymet og hæmme dets aktivitet. Docking-processen, hvor substrat sættes ind i det aktive sted, som en nøgle i en lås, gjorde det muligt for teamet at forfine strukturen af periwinkle-enzymet for at gøre modellens fine detaljer tættere på dem, der ses i naturen. For at gøre dette blev der brugt software til molekylær dynamik.
I sidste ende udvider værket, hvad der tidligere var kendt om periwinkle-enzymet og kunne tillade videnskabsmænd at ændre det på en sådan måde, at det virker på andre substrater. Men før det, da naturproduktet strictosidin i sig selv er et nyttigt udgangsmateriale for en lang række forskellige molekyler, åbner arbejdet op for nye veje til at arbejde med dette naturlige produkt. + Udforsk yderligere
Forskere udforsker enzymer, der bruger en kation, ikke oxygentilsætning, til at drive reaktioner
 Varme artikler
Varme artikler
-
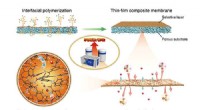 Forskere gør gennembrud inden for ionledende kompositmembranerFremstillingen og funktionen af tyndfilmskompositmembranen. Kredit:DAI Qing Kinesiske forskere under ledelse af Profs. Li Xianfeng og Zhang Huamin fra Dalian Institute of Chemical Physics (DICP)
Forskere gør gennembrud inden for ionledende kompositmembranerFremstillingen og funktionen af tyndfilmskompositmembranen. Kredit:DAI Qing Kinesiske forskere under ledelse af Profs. Li Xianfeng og Zhang Huamin fra Dalian Institute of Chemical Physics (DICP) -
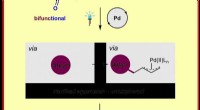 Undervisning i gamle overgangsmetaller nye tricks:Kemikere aktiverer palladiumkatalyse ved lysKemisk illustration af den nye metode til fremstilling af π-allylpalladiumkomplekser ved radikal kemi Kredit:Frank Glorius Ved fremstilling af forbindelser, kemikere har det grundlæggende mål at f
Undervisning i gamle overgangsmetaller nye tricks:Kemikere aktiverer palladiumkatalyse ved lysKemisk illustration af den nye metode til fremstilling af π-allylpalladiumkomplekser ved radikal kemi Kredit:Frank Glorius Ved fremstilling af forbindelser, kemikere har det grundlæggende mål at f -
 Sporing af laboratoriedyrket væv med lysEn tom petriskål med to optiske fibre, illustrerer en version af forskernes eksperiment. Den venstre fiber (normalt skinnende infrarødt lys, men afbildet her som synligt rødt lys) er en temperatursens
Sporing af laboratoriedyrket væv med lysEn tom petriskål med to optiske fibre, illustrerer en version af forskernes eksperiment. Den venstre fiber (normalt skinnende infrarødt lys, men afbildet her som synligt rødt lys) er en temperatursens -
 Superfleksible aerogeler er meget effektive absorbenter, termiske isolatorer, og tryksensorerKredit:Wiley Luftig, Luftigere, Aerogel. Indtil nu, skørhed har begrænset den praktiske anvendelse af disse sarte faste stoffer, som næsten udelukkende består af luftfyldte porer. Dette kan nu ænd
Superfleksible aerogeler er meget effektive absorbenter, termiske isolatorer, og tryksensorerKredit:Wiley Luftig, Luftigere, Aerogel. Indtil nu, skørhed har begrænset den praktiske anvendelse af disse sarte faste stoffer, som næsten udelukkende består af luftfyldte porer. Dette kan nu ænd
- Forskning styrker muligheden for pladetektonik på Europa
- En nanokelvin-mikrobølgefryser til molekyler
- Undersøgelse:Fængslede personer anbragt i isolation adskiller sig væsentligt fra andre i fængsel…
- Forskere finder, at bunden af Stillehavet bliver koldere, muligvis på grund af lille istid
- Hvordan kunstig intelligens kunne sænke omkostningerne ved atomenergi
- Et nyt våben i kampen mod superbugs


