Ændring af perspektivet på oprindelsen af enzymatisk katalytisk kraft
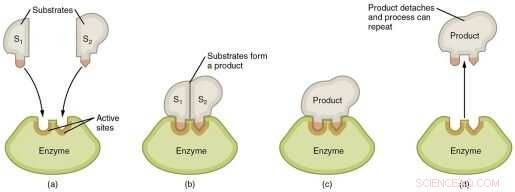
Grafisk fremstilling af trinene i en enzymatisk reaktion. Kredit:Wikimedia Commons
De enzymer, der findes i levende organismer, har en imponerende katalytisk kraft. Takket være enzymer sker de kemiske reaktioner, der opretholder livet, millioner af gange hurtigere, end de ville ske uden dem. Enzymer fremskynder reaktioner ved at hjælpe med at sænke den aktiveringsenergi, der er nødvendig for at starte dem, men i mere end 70 år har, hvordan enzymer opnår dette, været genstand for intens debat.
Dr. Tor Savidge, professor i patologi og immunologi ved Baylor College of Medicine og Texas Children's Microbiome Center, og hans kolleger ændrer måden at se på dette gamle argument. I deres arbejde udgivet i Chemical Science , undersøgte de lighederne og forskellene mellem de to mekanismer, der i øjeblikket er til debat, ved at karakterisere katalytiske reaktioner på et detaljeret molekylært niveau.
"På nuværende tidspunkt foreslås to store forskellige reaktionsmekanismer for at forklare enzymatisk katalytisk kraft," sagde Savidge. "Den ene foreslår, at enzymer sænker reaktionens aktiveringsenergi via stabilisering af overgangstilstande (TS), og den anden, at de gør det ved at destabilisere grundtilstanden (GS) af enzymer. Den nuværende idé er, at disse mekanismer er gensidigt udelukkende."
Førsteforfatter Dr. Deliang Chen ved Gannan Normal University i Kina og hans kolleger anlagde en teoretisk tilgang under hensyntagen til tidligere resultater fra Savidge-laboratoriet, der viser, at de ikke-kovalente vekselvirkninger mellem substrater og enzymer med vand er vigtige i forhold til mekanismen af det enzymatiske reaktioner.
"I et biologisk miljø skal du overveje vandet - at det kommer til at forstyrre de meget komplekse atomare interaktioner, der forekommer i enzymets aktive sted. Vi er nødt til at overveje dem alle for at forstå, hvor præcis du skal have elektrostatiske interaktioner, der er vil favorisere den enzymatiske proces," sagde Savidge. "Når du tager det i betragtning, kan du forstå, hvordan disse mekanismer fungerer."
Deres analyser fik holdet til at foreslå noget nyt:at TS og GS trods alt ikke er så forskellige. De bruger en lignende atommekanisme til at booste den enzymatiske reaktion fremad. Mekanismen involverer vand i at ændre ladningen af vigtige rester i det katalytiske sted på en måde, der begunstiger dannelsen af en energetisk gunstig tilstand, der driver den enzymatiske reaktion til at forekomme.
"Det vigtige, nye punkt her er ikke, hvordan dette opnås, men hvornår det opnås," sagde Savidge. "Vi har vist, at ved stabilisering af overgangstilstande dannes ladningerne, der driver reaktionen fremad, før substratet kommer ind i det aktive sted. Mens det er i destabiliseringsgrundtilstanden sker dette også, men efter at substratet kommer ind i det aktive sted."
Forskerne foreslog også, at den fælles mekanisme mellem TS og GS er universel; det kan anvendes på mange enzymatiske reaktioner.
Deres resultater har vigtige implikationer, ikke kun for at hjælpe forskere med bedre at forstå enzymernes katalytiske kraft, men også for praktiske lægemiddeldesignapplikationer.
"Vi bruger vores resultater til mere dybt at udforske mikrobiel enzymatisk katalyse i forskellige miljøer og til at designe kunstige enzymer," sagde Savidge.
Yibao Li, Xun Li, Xiaolin Fan ved Gannan Normal University og Xuechuan Hong ved Wuhan University School of Pharmaceutical Sciences bidrog også til dette arbejde. + Udforsk yderligere
Kortlægning af elektriske felter for at hjælpe med at optrevle, hvordan enzymer fungerer
 Varme artikler
Varme artikler
-
 Origami inspirerer til ny teknologi til vævsregenereringUMass Lowell Prof. Gulden Camci-Unal arbejder sammen med studerende Xinchen Wu om biomaterialeforskning ved universitetets Saab Emerging Technologies and Innovation Center. Kredit:Edwin Aguirre for UM
Origami inspirerer til ny teknologi til vævsregenereringUMass Lowell Prof. Gulden Camci-Unal arbejder sammen med studerende Xinchen Wu om biomaterialeforskning ved universitetets Saab Emerging Technologies and Innovation Center. Kredit:Edwin Aguirre for UM -
 Grøn kemi og biobrændstof:Mekanismen for et centralt fotoenzym dekrypteretKunstnerindtryk af den enzymatiske katalyse foreslået i mekanisme af fedtsyrefotodecarboxylase. Kredit:Damien Sorigué Funktionen af enzymet FAP, nyttig til produktion af biobrændstoffer og til g
Grøn kemi og biobrændstof:Mekanismen for et centralt fotoenzym dekrypteretKunstnerindtryk af den enzymatiske katalyse foreslået i mekanisme af fedtsyrefotodecarboxylase. Kredit:Damien Sorigué Funktionen af enzymet FAP, nyttig til produktion af biobrændstoffer og til g -
 Forskere designer dinuclear-site katalysatorer og afslører den underliggende mekanismeSynteseskema. Kredit:DING Tao et al. Dinuclear-site katalysatorer (DSCer) har tiltrukket sig mere og mere opmærksomhed fra forskere på grund af deres fremragende katalytiske evne ved at inkorporer
Forskere designer dinuclear-site katalysatorer og afslører den underliggende mekanismeSynteseskema. Kredit:DING Tao et al. Dinuclear-site katalysatorer (DSCer) har tiltrukket sig mere og mere opmærksomhed fra forskere på grund af deres fremragende katalytiske evne ved at inkorporer -
 Upcycling af fast fashion for at reducere spild og forureningGenbrug af bomuld-polyestertøj er tættere på virkeligheden med en ny metode, der kan (1) opløse de blandede materialer, (2) adskiller cellulosen og (3) centrifugerer nye lyocell-lignende fibre. Kredit
Upcycling af fast fashion for at reducere spild og forureningGenbrug af bomuld-polyestertøj er tættere på virkeligheden med en ny metode, der kan (1) opløse de blandede materialer, (2) adskiller cellulosen og (3) centrifugerer nye lyocell-lignende fibre. Kredit
- Porøs kulfiberforskning et skridt nærmere brug i bilindustrien
- Sådan beregnes cellekoncentration
- NASA hjælper Kilauea -katastrofeberedskab
- Ny algoritme kan hjælpe med at forbedre design af cellulære materialer
- Ny satellit vil kaste lys fra luften for at måle vind (Opdatering)
- Demonstration af en svag topologisk isolator i bismuthiodid


