Computersimuleringer af proteiner hjælper med at opklare, hvorfor kemoterapiresistens opstår
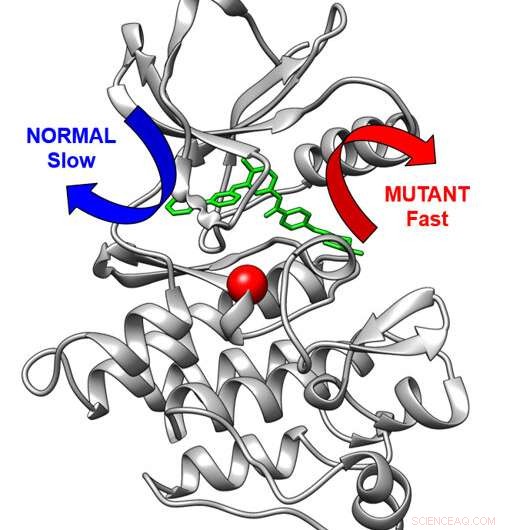
Tredimensionel struktur af kræftlægemidlet Abl-kinase (grå) bundet til kræftlægemidlet imatinib. Normalt forlader lægemidlet langsomt via den blå pil. En modifikation i kinasen (rød kugle) får lægemidlet til at forlade via en hurtig rute (rød pil). Kredit:Aziz M. Rangwala
At forstå hvorfor og hvordan kemoterapiresistens opstår er et stort skridt i retning af at optimere behandlinger for kræft. Et team af videnskabsmænd, herunder Markus Seeliger, Ph.D., fra Stony Brook Cancer Center og Renaissance School of Medicine ved Stony Brook University, mener, at de har fundet en ny proces, hvorigennem lægemiddelresistens opstår. De bruger en computersimuleringsmodel, der hjælper dem med at forstå præcis, hvordan molekyler interagerer med kræftlægemidlet Imatinib (kendt som Gleevec) i den kemoterapiresistente proces. Imatinib behandler kronisk myeloid leukæmi (CML) yderst effektivt, men alligevel oplever mange patienter i sent stadium lægemiddelresistens, hvilket gør lægemidlet minimalt effektivt på det stadium.
Forskningen fremhæves i et papir offentliggjort i Angewandte Chemie og bygger på tidligere forskning detaljeret i 2021 i PNAS .
Imatinib hæmmer BCR-Abl-proteinkinasen, et overdrevent aktivt cellulært signaleringsmaskineri i CML. I PNAS undersøgelse viste forskere, at variationer i kinasens byggeplan kan gøre det sværere for Imatinib at binde sig til kinasen og også fremskynde frigivelsen af lægemidler fra kinasen. I Angewandte Chemie papir, tog forskerholdet beregningsmetoden – udviklet af medforfatter Pratyush Tiwary fra University of Maryland – som satte dem i stand til at studere den meget langsomme frigivelse af Imatinib fra kinasen.
"Denne metode i sig selv er en stor teknisk præstation, der udvider beregningsevnerne for forskning i lægemiddelresistens, og som vigtigst førte til, at vi var i stand til at forudsige, hvor hurtigt sunde og mutante proteiner ville frigive dette lægemiddel," siger Seeliger, lektor ved Institut for Farmakologisk Videnskaber. "For første gang kunne vi se frigivelsen af et lægemiddel fra et protein så detaljeret og nøjagtigt. Desuden kunne vi vise, at mutationen ændrer sig fundamentalt inden for lægemidlets udgangsvej fra proteinet.
"Dette er vigtigt, da hastigheden af lægemiddelfrigivelsen kan være lige så vigtig for den terapeutiske effekt af et lægemiddel som hvor tæt et lægemiddel binder til proteinet."
Seeliger forklarer yderligere, at metoden kunne give et grundlag for at forstå de molekylære mekanismer bag kemoterapiresistens.
Mere generelt er implikationerne af det, de opdagede, at hvis forskere kan forstå, hvordan lægemidler frigives fra deres proteiner, kan de muligvis designe lægemidler med en langsommere frigivelse og højere terapeutisk effekt. Derudover, hvis hurtig frigivelse af lægemidler kan forårsage lægemiddelresistens, og klinikere kan vise, at dette sker, kan de muligvis genaktivere lægemidlets effektivitet ved at bede patienten om at tage lægemidlet oftere.
Grundlaget for mutationstestningen via beregningsmetoden blev skitseret i PNAS papir. Seeliger og kolleger testede, hvordan imatinib binder til mutationer hos patienter med imatinib-resistent CML. De fandt ud af, at størstedelen af mutationer let binder til imatinib, så det stillede spørgsmålet, hvordan disse mutationer forårsager resistens hos patienter? Forskerne identificerede derefter adskillige mutanter, som hurtigt binder imatinib, men som frigiver stoffet meget hurtigere.
Efter at have identificeret disse mutanter med en hurtigere lægemiddelfrigivelse, brugte holdet nuklear magnetisk resonans (NMR) og molekylær dynamik til at forbinde proteinet med lægemiddeldisassociation - hvilket ligger til grund for vigtigheden af lægemiddeldisassociationskinetik for lægemiddeleffektivitet. Dette gjorde dem i stand til at identificere en ny mekanisme for imatinib-resistens.
Arbejdet resulterede i papiret offentliggjort i PNAS involveret samarbejdet mellem Seeliger og hans kolleger ved Stony Brook og forskere ved Memorial Sloan Kettering Cancer Center og ved Goethe University of Frankfurt, Tyskland.
Forskning, der resulterede i det nyere papir, blev ledet af Tiwary og kolleger ved University of Maryland i samarbejde med Seeliger og forskere ved Broad Institute ved MIT og Harvard University. + Udforsk yderligere
Ny computersimulering knækker mysteriet om kræftresistens
 Varme artikler
Varme artikler
-
 Lysaktiveret metalkatalysator ødelægger kræftcellernes vitale energikildeKredit:University of Warwick Et metal i en rumalder, der var en del af asteroiden, der ødelagde dinosaurerne, kunne give en ny metode til selektiv behandling af kræfttumorer ved hjælp af lys. For
Lysaktiveret metalkatalysator ødelægger kræftcellernes vitale energikildeKredit:University of Warwick Et metal i en rumalder, der var en del af asteroiden, der ødelagde dinosaurerne, kunne give en ny metode til selektiv behandling af kræfttumorer ved hjælp af lys. For -
 Sådan finder du antallet af neutroner i en isotopAtomer udgør alt det. Alt med masse og volumen, store eller små, indeholder atomer. Utroligt nok indeholder de små atomer endnu mindre partikler. Protoner, neutroner og elektroner er de tre hovedkompo
Sådan finder du antallet af neutroner i en isotopAtomer udgør alt det. Alt med masse og volumen, store eller små, indeholder atomer. Utroligt nok indeholder de små atomer endnu mindre partikler. Protoner, neutroner og elektroner er de tre hovedkompo -
 Ny metode giver forskere mulighed for hurtigt at se individuelle viruspartiklerEt sammensat billede af herpes simplex virus partikler, opnået af AFM-IR. (Billede udlånt af Dmitry Kurouski) Influenza, SARS-CoV-2 og andre vira kommer i en lang række forskellige former og størr
Ny metode giver forskere mulighed for hurtigt at se individuelle viruspartiklerEt sammensat billede af herpes simplex virus partikler, opnået af AFM-IR. (Billede udlånt af Dmitry Kurouski) Influenza, SARS-CoV-2 og andre vira kommer i en lang række forskellige former og størr -
 Vand, jordanalyseteknologi kan hjælpe med at forbedre oprydning og overvågning på forurenede Supe…Kredit:CC0 Public Domain Mindst 53 millioner amerikanere, inklusive omkring 18 procent af landets børn, bor mindre end tre miles fra en Superfund-side, ifølge Miljøstyrelsen. Kongressen oprettede
Vand, jordanalyseteknologi kan hjælpe med at forbedre oprydning og overvågning på forurenede Supe…Kredit:CC0 Public Domain Mindst 53 millioner amerikanere, inklusive omkring 18 procent af landets børn, bor mindre end tre miles fra en Superfund-side, ifølge Miljøstyrelsen. Kongressen oprettede
- Forskere maksimerer effektiviteten af platin i brændselsceller
- Låser op for mysteriet med pollenrørføring
- Observationer bekræfter, at aerosoler dannet af plante-emitterede forbindelser kan gøre skyer lyse…
- Sådan fungerer spillemaskiner – og hvorfor du bør tænke dig om, før du spiller dem
- Earths 2017 ressourcebudget brugt pr. 2. august:rapport
- Hvordan man bruger peber til egern Repellent


