Undersøgelse af små molekyle-RNA-interaktioner ved at se gennem SKOVEN
Et team af forskere har for nylig demonstreret nytten af at anvende et tidligere etableret screeningsystem til at undersøge interaktionerne mellem små molekyler og RNA. Deres undersøgelse er offentliggjort i Communications Chemistry .
Holdet blev ledet af professor Hirohide Saito (Department of Life Science Frontiers, CiRA), Dr. Kaoru R. Komatsu (en tidligere ph.d.-studerende i CiRA), lektor Kazumitsu Onizuka og professor Fumi Nagatsugi (Institute of Multidisciplinary Research for avancerede materialer, Tohoku University).
Fra nylige SARS-CoV-2 mRNA-vacciner til bekæmpelse af COVID-19-pandemien til risdiplam, en RNA-splejsningsmodifikator godkendt af US Food and Drug Administration til spinal muskelatrofi, er ordet "RNA" indgået i et almindeligt sprog, da det repræsenterer både nye klasser af terapeutiske midler og lægemiddelmål.
Vores forståelse af, hvordan forskellige RNA-sekvenser og til gengæld strukturer dikterer interaktioner med små molekyler såsom lægemiddelforbindelser eller store biomolekyler såsom proteiner, er dog stadig ufuldstændig.
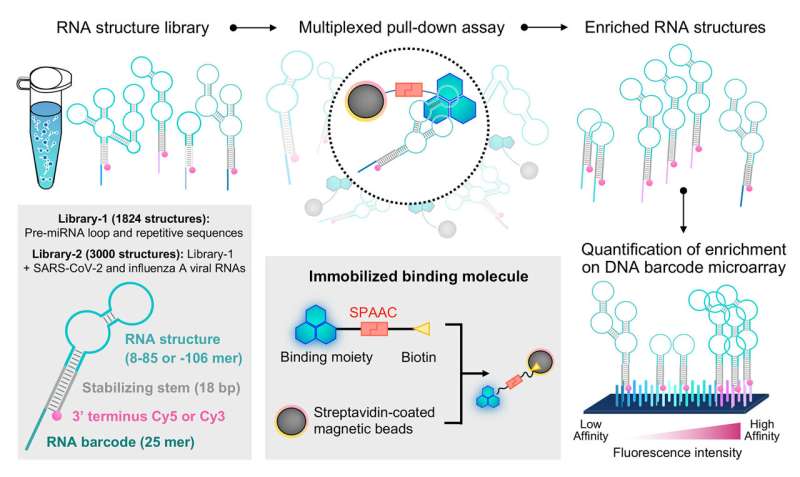
I et tidligere studie designede professor Saito og hans forskerhold et system kaldet foldet RNA-elementprofilering med strukturbibliotek, eller FOREST, for at undersøge de molekylære detaljer om, hvordan RNA interagerer med kendte RNA-bindende proteiner.
Til denne nye undersøgelse, gennem et samarbejde med forskere fra Tohoku University, illustrerede det fælles forskerhold, hvordan FOREST kan bruges til at analysere små molekylære interaktioner med RNA.
Forskerholdet validerede først anvendeligheden af FOREST-tilgangen til små molekyler ved at undersøge, hvordan et RNA-strukturbibliotek interagerer med kendte små molekylære RNA-interaktorer:G-klemme og thiazinorange (TO) derivater.
Forskerne isolerede RNA-strukturer bundet til G-clamp fra et bibliotek omfattende mere end 1.800 RNA-sekvenser afledt af humane pre-miRNA'er og andre gentagne og kontrolsekvenser. Fordi disse RNA-strukturer er knyttet til et fluorescerende farvestof og RNA-stregkode, kunne de let afkodes og kvantificeres af et DNA-mikroarray med sekvenser, der er komplementære til RNA-stregkoderne for at give en kvantitativ analyse af, hvordan RNA-strukturer interagerer med det specifikke lille molekyle af interesse.
Som forventet identificerede de præferentiel binding til guanosin (G)-holdige enkelt- og dobbeltstrengede RNA-sekvenser (henholdsvis ssRNA og dsRNA) ved hjælp af G-clamp. Fra RNA-strukturbiblioteket valgte forskerholdet sekvenser, der viser høj-, mellem- eller lavaffinitetsbinding til G-clamp til validering af et uafhængigt fluorescensbaseret eksperiment, der direkte måler tilsyneladende dissociationskonstanter for individuelle interaktioner.
Bemærkelsesværdigt observerede de en god korrelation mellem den relative bindingsaffinitet estimeret ved FOREST-tilgangen og de tilsyneladende dissociationskonstanter bestemt af det fluorescensbaserede bindingsassay, hvilket indikerer den høje robusthed af denne metode til kvantificering af små molekyle-RNA-interaktioner.
Ved at mutere en specifik RNA-løkkestruktur med flere guanosiner på forskellige steder, opdagede de endvidere, at G-clamp ikke interagerer lige meget med alle guanosiner på løkken, men at yderligere strukturel kontekst kan påvirke interaktionen.
Omvendt er TO-derivater almindeligt anvendte prober til fluorescerende indikatorforskydningsassays (FID). Forskerne blandede derefter TO og TO-3 separat med et udvidet RNA-strukturbibliotek indeholdende yderligere sekvenser afledt af SARS-CoV-2 og influenza A-virus-RNA'er for bedre at karakterisere TO-derivater til RNA-målinger.
Som forventet, mens der ikke var nogen sammenhæng mellem bindingsprofiler af RNA-strukturer, der interagerer med G-clamp og TO-derivater, delte TO og TO-3 lignende bindingsprofiler med nogle mindre forskelle.
Yderligere sammenligninger mellem TO-N3 , TO-N3 -2 og TO-3-N3 afslørede, at linkerposition har en beskeden indflydelse på RNA-bindingsprofiler. Baseret på disse bindingsprofiler har forskerne desuden fundet nogle base- og loop-positionelle præferencer, som TO-derivater har, når de interagerer med RNA-strukturer.
Forskerholdet udvidede desuden deres analyse af TO-derivater ved at sammenligne relative bindingsaffiniteter bestemt af FOREST med de tilsyneladende dissociationskonstanter målt for kommercielt tilgængelige fluorescerende nukleinindikatorer, TO-PRO-1 og TO-PRO-3, ved det fluorescensbaserede bindingsassay .
Gennem denne analyse afslørede de, at mens TO-N3 -2 kan mere præcist afbilde TO-PRO1's bindingsprofil sammenlignet med TO-3-N3 , både TO-N3 -2 og TO-3-N3 simulerer TO-PRO-3 omtrent lige så godt, hvilket giver afgørende strukturel indsigt til forbedring af parring af mål-RNA og fluorescerende indikatorer til FID-assays.
Ved at bruge bindingsprofilerne bestemt for TO-derivater valgte forskerholdet kombinationer af fluorescerende indikatorer (TO-PRO-1 eller TO-PRO-3) og pre-miRNA-sekvenser, der tidligere har vist sig at være dysregulerede i tumorer med mellemliggende bindingsaffiniteter til FID-assays.
Som et proof-of-concept screenede forskerne et kommercielt tilgængeligt kemisk bibliotek med 118 forbindelser for at identificere små molekyler, der er i stand til at interagere med sygdomsassocierede pre-miRNA'er. Gennem denne indsats identificerede de baicalein (Bai), myricetin (Myr), chelerythrinchlorid (Che) og AS 602801 (AS) som kandidat-hitforbindelser. Mens Myr og Che er kendt for at binde DNA og RNA, var dette den første demonstration af AS som en nukleinsyreinteraktor.
Forskerne observerede især forskellige resultater, når TO-PRO-1 eller TO-PRO-3 blev brugt som fluorescerende indikator, hvilket tyder på, at forskellige indikatorer bør anvendes for at undgå falske positive og negative identifikationer. Yderligere undersøgelse af AS bekræftede binding til adskillige humane pre-miRNA'er af interesse, men forskerne bemærkede også, at forbindelsen udviste stærke lysende egenskaber, når den interagerer med RNA.
Strukturel undersøgelse af forbindelsen tyder på, at den indeholder en kemisk del, der sandsynligvis er ansvarlig for lysegenskaberne, hvilket gør den til en forbindelse af interesse for yderligere udvikling til en ny RNA-interaktor og fluorescerende probe.
I denne undersøgelse illustrerer den fælles forskningsindsats endnu en gang anvendeligheden af FOREST-metoden, ikke kun til inspektion af RNA-protein-interaktioner, men også til at undersøge de fine detaljer i interaktioner mellem RNA og små molekyler.
I betragtning af det enorme potentiale for RNA som en ny terapeutisk tilgang i næste generations medicin, vil evnen til systemisk at karakterisere små molekyle-RNA-interaktioner i store skalaer have enorm indflydelse på grundlæggende RNA-forskning og oversættelsen af denne viden til terapier.
Flere oplysninger: Ryosuke Nagasawa et al., Storskalaanalyse af små molekyle-RNA-interaktioner ved brug af multipleksede RNA-strukturbiblioteker, Communications Chemistry (2024). DOI:10.1038/s42004-024-01181-8
Journaloplysninger: Kommunikationskemi
Leveret af Kyoto University
 Varme artikler
Varme artikler
-
 Indfanger den overraskende fleksibilitet af krystaloverfladerHoldet observerede, at PCP-overfladen fluktuerede fleksibelt. Kredit:Izumi Mindy Takamiya Billeder taget ved hjælp af et atomkraftmikroskop har gjort det muligt for forskere at observere, for førs
Indfanger den overraskende fleksibilitet af krystaloverfladerHoldet observerede, at PCP-overfladen fluktuerede fleksibelt. Kredit:Izumi Mindy Takamiya Billeder taget ved hjælp af et atomkraftmikroskop har gjort det muligt for forskere at observere, for førs -
 Nye elektronbriller skærper vores syn på atomare skala funktionerEn aberration-korrektionsalgoritme (nederst) gør atom probe tomografi (APT) på niveau med scanning transmission elektronmikroskopi (STEM) (øverst) - en industristandard - til karakterisering af urenhe
Nye elektronbriller skærper vores syn på atomare skala funktionerEn aberration-korrektionsalgoritme (nederst) gør atom probe tomografi (APT) på niveau med scanning transmission elektronmikroskopi (STEM) (øverst) - en industristandard - til karakterisering af urenhe -
 Kemikere, der overraskende opdagede nanokonfinerede reaktioner, kunne hjælpe med katalytisk designKredit:Georgia State University Georgia State University kemiforskere har afsløret et af mysterierne bag katalytiske reaktioner i mikroskopisk skala, giver mulighed for design af mere effektive in
Kemikere, der overraskende opdagede nanokonfinerede reaktioner, kunne hjælpe med katalytisk designKredit:Georgia State University Georgia State University kemiforskere har afsløret et af mysterierne bag katalytiske reaktioner i mikroskopisk skala, giver mulighed for design af mere effektive in -
 Biokemikere bruger nyt værktøj til at kontrollere mRNA ved hjælp af lys5′-hætten er et kendetegn for eukaryote mRNAer, der styrer translationsinitiering. a, Nøgletrin i oversættelsesinitiering. Den eukaryote translationsinitieringsfaktor eIF4E binder direkte til 5′-hætte
Biokemikere bruger nyt værktøj til at kontrollere mRNA ved hjælp af lys5′-hætten er et kendetegn for eukaryote mRNAer, der styrer translationsinitiering. a, Nøgletrin i oversættelsesinitiering. Den eukaryote translationsinitieringsfaktor eIF4E binder direkte til 5′-hætte
- Forskere er pionerer i maskinlæring for at fremskynde kemiske opdagelser, reducere spild
- Brug af virtual reality-systemer til at undervise i kemi i 3-D
- Hvordan tavse miljøforkæmpere kunne hjælpe med at beskytte biodiversiteten
- Sådan bygger du et bedre Canada efter COVID-19:Kraften i hverdagens handlinger kan skabe forandring
- Sådan gemmer du magneter
- Styrende kræfter mellem atomer, molekyler, lovende for 2-D hyperbolske materialer


