Simuleret kemi:Ny AI-platform designer morgendagens kræftlægemidler
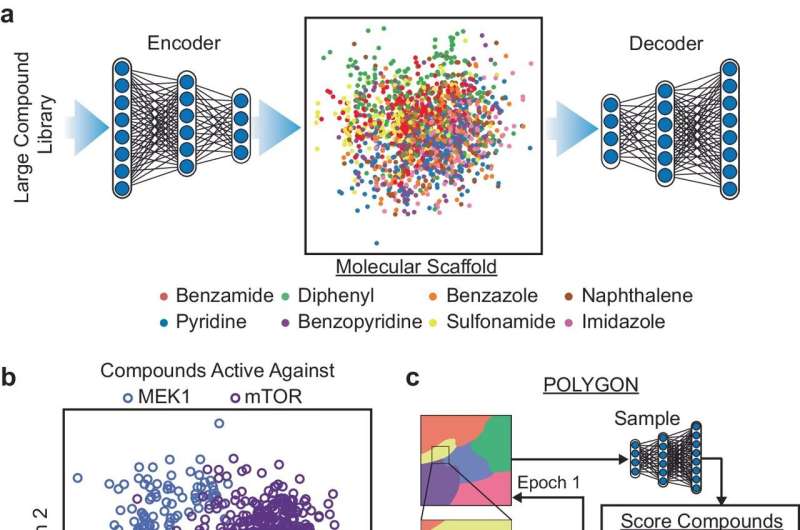
Forskere ved UC San Diego har udviklet en maskinlæringsalgoritme til at simulere den tidskrævende kemi, der er involveret i de tidligste faser af lægemiddelopdagelse, hvilket kan strømline processen betydeligt og åbne døre for aldrig før sete behandlinger.
At identificere kandidatlægemidler til yderligere optimering involverer typisk tusindvis af individuelle eksperimenter, men den nye kunstig intelligens (AI) platform kan potentielt give de samme resultater på en brøkdel af tiden. Forskerne brugte det nye værktøj, beskrevet i Nature Communications , for at syntetisere 32 nye lægemiddelkandidater mod kræft.
Teknologien er en del af en ny, men voksende tendens inden for farmaceutisk videnskab med at bruge kunstig intelligens til at forbedre opdagelse og udvikling af lægemidler.
"For et par år siden var AI et beskidt ord i medicinalindustrien, men nu er tendensen absolut den modsatte, hvor biotekstartups har svært ved at rejse penge uden at adressere AI i deres forretningsplan," siger seniorforfatter Trey Ideker, professor i Institut for Medicin ved UC San Diego School of Medicine og adjungeret professor i bioteknik og datalogi ved UC San Diego Jacobs School of Engineering.
"AI-styret lægemiddelopdagelse er blevet et meget aktivt område i industrien, men i modsætning til de metoder, der udvikles i virksomheder, gør vi vores teknologi open source og tilgængelig for alle, der ønsker at bruge den."
Den nye platform, kaldet POLYGON, er unik blandt AI-værktøjer til lægemiddelopdagelse, idet den kan identificere molekyler med flere mål, mens eksisterende lægemiddelopdagelsesprotokoller i øjeblikket prioriterer enkeltmålsterapier. Multi-target lægemidler er af stor interesse for læger og videnskabsmænd på grund af deres potentiale til at levere de samme fordele som kombinationsterapi, hvor flere forskellige lægemidler bruges sammen til behandling af kræft, men med færre bivirkninger.
"Det tager mange år og millioner af dollars at finde og udvikle et nyt lægemiddel, især hvis vi taler om et med flere mål," sagde Ideker. "De sjældne få multi-target-lægemidler, vi har, blev opdaget ved en tilfældighed, men denne nye teknologi kunne hjælpe med at tage chancen ud af ligningen og kickstarte en ny generation af præcisionsmedicin."
Forskerne trænede POLYGON på en database med over en million kendte bioaktive molekyler, der indeholder detaljerede oplysninger om deres kemiske egenskaber og kendte interaktioner med proteinmål. Ved at lære af mønstre fundet i databasen er POLYGON i stand til at generere originale kemiske formler for nye kandidatlægemidler, der sandsynligvis vil have visse egenskaber, såsom evnen til at hæmme specifikke proteiner.
"Ligesom AI nu er meget god til at generere originale tegninger og billeder, såsom at skabe billeder af menneskelige ansigter baseret på ønskede egenskaber som alder eller køn, er POLYGON i stand til at generere originale molekylære forbindelser baseret på ønskede kemiske egenskaber," sagde Ideker.
"I dette tilfælde, i stedet for at fortælle AI'en, hvor gammelt vi ønsker, at vores ansigt skal se ud, fortæller vi det, hvordan vi ønsker, at vores fremtidige lægemiddel interagerer med sygdomsproteiner."
For at sætte POLYGON på prøve, brugte forskerne det til at generere hundredvis af kandidatlægemidler, der er målrettet mod forskellige par af kræftrelaterede proteiner.
Af disse syntetiserede forskerne 32 molekyler, der havde de stærkest forudsagte interaktioner med MEK1- og mTOR-proteinerne, et par cellulære signalproteiner, der er et lovende mål for kombinationsbehandling med kræft. Disse to proteiner er, hvad forskerne kalder syntetisk dødelige, hvilket betyder, at inhibering af begge sammen er nok til at dræbe kræftceller, selvom det ikke er tilfældet at hæmme én alene.
Forskerne fandt ud af, at de lægemidler, de syntetiserede, havde betydelig aktivitet mod MEK1 og mTOR, men havde få reaktioner uden for målet med andre proteiner. Dette tyder på, at et eller flere af de lægemidler, der er identificeret af POLYGON, kunne være i stand til at målrette begge proteiner som en kræftbehandling, hvilket giver en liste over muligheder for finjustering af menneskelige kemikere.
"Når du først har de kandidatstoffer, skal du stadig gøre al den anden kemi, der skal til for at forfine disse muligheder til en enkelt, effektiv behandling," sagde Ideker. "Vi kan og bør ikke forsøge at eliminere menneskelig ekspertise fra lægemiddelopdagelsespipelinen, men hvad vi kan gøre er at forkorte et par trin af processen."
På trods af denne forsigtighed er forskerne optimistiske over, at AIs muligheder for lægemiddelopdagelse kun lige er ved at blive udforsket.
"At se, hvordan dette koncept udspiller sig i løbet af det næste årti, både i den akademiske verden og i den private sektor, bliver meget spændende," sagde Ideker. "Mulighederne er stort set uendelige."
Flere oplysninger: Brenton P. Munson et al., De novo generation af multi-target forbindelser ved hjælp af dyb generativ kemi, Nature Communications (2024). DOI:10.1038/s41467-024-47120-y. www.nature.com/articles/s41467-024-47120-y
Journaloplysninger: Nature Communications
Leveret af University of California - San Diego
 Varme artikler
Varme artikler
-
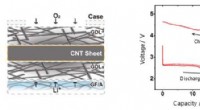 Udvikling af lithium-luft-batterier med ultrahøj kapacitet ved brug af CNT-arkluftelektroderKonceptuelt diagram af en CNT-arkluftelektrode (venstre) og opladnings-afladningskarakteristika for lithium-luftbatteriet med ultrahøj kapacitet (højre). Kredit:National Institute for Materials Scienc
Udvikling af lithium-luft-batterier med ultrahøj kapacitet ved brug af CNT-arkluftelektroderKonceptuelt diagram af en CNT-arkluftelektrode (venstre) og opladnings-afladningskarakteristika for lithium-luftbatteriet med ultrahøj kapacitet (højre). Kredit:National Institute for Materials Scienc -
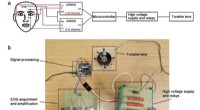 Øjestyret blød linse baner vej til bløde menneske-maskine-grænsefladerSkematisk og foto af det bløde linsesystem. Kredit:Cai lab/avancerede funktionelle materialer Et forskerhold ledet af University of California San Diego har udviklet en blød robotlinse, hvis bevæg
Øjestyret blød linse baner vej til bløde menneske-maskine-grænsefladerSkematisk og foto af det bløde linsesystem. Kredit:Cai lab/avancerede funktionelle materialer Et forskerhold ledet af University of California San Diego har udviklet en blød robotlinse, hvis bevæg -
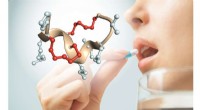 Peptider, der kan tages som en pilleStruktur af et dobbeltbro-peptid, der ikke nedbrydes af enzymer i mave og tarme. De to stabiliserende kemikaliebroer er vist med rødt. Kredit:C. Heinis (EPFL) Peptider er korte kæder af aminosyrer
Peptider, der kan tages som en pilleStruktur af et dobbeltbro-peptid, der ikke nedbrydes af enzymer i mave og tarme. De to stabiliserende kemikaliebroer er vist med rødt. Kredit:C. Heinis (EPFL) Peptider er korte kæder af aminosyrer -
 Nyt værktøj til at forudsige polymeregenskaberKredit:Gent Universitet Et tværfagligt team af forskere har udviklet et kraftfuldt matematisk modelleringsværktøj, der vil give forskere mulighed for at forudsige egenskaberne af polymernetværk, f
Nyt værktøj til at forudsige polymeregenskaberKredit:Gent Universitet Et tværfagligt team af forskere har udviklet et kraftfuldt matematisk modelleringsværktøj, der vil give forskere mulighed for at forudsige egenskaberne af polymernetværk, f
- NASA ser den tropiske storm Bebinca stadig nær Hainan-øen
- Billede:Lille satellit demonstrerer mulig løsning for rumskram
- Sådan konverteres gentagne decimaler til procentdele
- Undersøgelse viser, at børn med lavere økonomisk status er mere villige til at træffe risikable …
- Hvordan man estimerer Crowd Density
- Forvandling af træ til plastik


