Peptider, der kan tages som en pille

Struktur af et dobbeltbro-peptid, der ikke nedbrydes af enzymer i mave og tarme. De to stabiliserende kemikaliebroer er vist med rødt. Kredit:C. Heinis (EPFL)
Peptider er korte kæder af aminosyrer, der forekommer i vores krop, i planter eller bakterier for at kontrollere forskellige funktioner. Adskillige peptider bruges som lægemidler såsom insulin, som styrer metabolismen af sukker; og cyclosporin, som undertrykker organafstødning efter transplantationer. Mere end 40 peptider er allerede godkendt som lægemidler, generere indtægter i milliardklassen. Der er flere hundrede af peptid-baserede lægemidler i øjeblikket i kliniske forsøg.
Men næsten ingen af disse lægemiddelpeptider kan tages oralt. Da peptider er en vigtig del af mad, maven og tarmene rummer utallige enzymer, der kan nedbryde dem, hvilket betyder, at det meste peptidbaseret medicin ikke overlever passagen gennem mave-tarmkanalen.
Håbet om at generere mere stabile peptider kom fra 'cykliske' peptider, hvis ender er forbundet med kemiske broer, hvilket gør dem mere stabile end lineære, fordi deres rygrad er mindre fleksible og dermed sværere at angribe af enzymer. I 2018, forskergruppen af Christian Heinis ved EPFL udviklede et peptidformat kaldet dobbeltbroede peptider, hvor peptider ringsluttes af to kemiske broer, der giver endnu højere stabilitet. På trods af sin succes, de fleste sådanne peptider var ikke tilstrækkeligt stabile til at overleve det enorme enzymtryk, der findes i mave-tarmkanalen.
Nu, Heinis' gruppe har udviklet en ny metode, der blandt milliarder af dobbeltbroede peptider identificerer dem, der binder et sygdomsmål af interesse og overlever enzymer i mave-tarmkanalen. Metoden er publiceret i Natur biomedicinsk teknik , og involverer tre trin.
Først, milliarder af genetisk kodede tilfældige peptidsekvenser er ringsluttet af to kemiske broer, der pålægger konformationelle begrænsninger på peptidernes rygrad, så de er sværere at angribe af enzymer. Sekund, dette bibliotek af peptider udsættes for enzymer fra ko-tarm for at eliminere alle de peptider, der ikke er stabile. I det tredje og sidste trin, forskerne dypper målproteiner i puljen af overlevende peptider for at udfiske dem, der binder til det ønskede sygdomsmål. "Det er lidt ligesom at søge efter en nål i en høstak, og denne metode gør det nemt, siger Heinis.
Med denne metode, forskerne er for første gang lykkedes med at udvikle målspecifikke peptider, der kan modstå nedbrydning i mave-tarmkanalen. For eksempel, de gav mus et blypeptid, der hæmmer trombin - et vigtigt anti-trombose-mål - i form af en pille. Peptidet forblev intakt i maven og tarmene, og selvom det nåede blodbanen i ret små mængder, det meste af det forblev fuldstændigt intakt i hele mave-tarmkanalen. Dette er et vigtigt skridt hen imod udvikling af orale peptidlægemidler.
Heinis' gruppe anvender nu den nye metode til at udvikle orale peptider, der virker direkte på gastrointestinale mål, hvilket betyder, at de ikke behøver at rejse ind i blodbanen. "Vi fokuserer på kroniske inflammatoriske sygdomme i mave-tarmkanalen som Crohns sygdom og colitis ulcerosa samt bakterielle infektioner, " siger Heinis. "Vi er allerede lykkedes med at generere enzym-resistente peptider mod interleukin-23-receptoren, et vigtigt mål for disse sygdomme, som påvirker millioner af patienter over hele verden uden noget oralt lægemiddel tilgængeligt."
 Varme artikler
Varme artikler
-
 Det er ikke vibranium eller proto-adamantium, men forskeres nye legering kommer tæt påKredit:University of North Texas Fire gange stærkere end rustfrit stål, en unik legering blander krom, kobolt, jern, mangan og silicium. Det er ikke Black Panthers vibranium eller Captain America
Det er ikke vibranium eller proto-adamantium, men forskeres nye legering kommer tæt påKredit:University of North Texas Fire gange stærkere end rustfrit stål, en unik legering blander krom, kobolt, jern, mangan og silicium. Det er ikke Black Panthers vibranium eller Captain America -
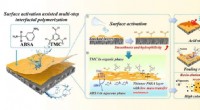 Nye syrefaste membraner til spildevandsrensning udvikletSkematisk mekanisme til fremstilling af syrefast nanofiltreringsmembran og dens overlegne separationsydelse. Kredit:CAO Yang En forskergruppe ledet af prof. Wan Yinhua fra Institute of Process Eng
Nye syrefaste membraner til spildevandsrensning udvikletSkematisk mekanisme til fremstilling af syrefast nanofiltreringsmembran og dens overlegne separationsydelse. Kredit:CAO Yang En forskergruppe ledet af prof. Wan Yinhua fra Institute of Process Eng -
 Oprettelse af mønstre spontant i syntetiske materialerEn polymerisationsfront markeret af varmegradienter (rød, højere temperatur) tillader spontan mønsterdannelse af polymerer med variable teksturer, farver og stivhed. Målestok, 1 cm. Kredit:Tilpasset f
Oprettelse af mønstre spontant i syntetiske materialerEn polymerisationsfront markeret af varmegradienter (rød, højere temperatur) tillader spontan mønsterdannelse af polymerer med variable teksturer, farver og stivhed. Målestok, 1 cm. Kredit:Tilpasset f -
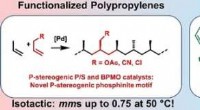 Katalysatorer for isotaktiske polære polypropylenerKredit: Angewandte Chemie International Edition Polypropylen (PP) er en af de mest anvendte plastmaterialer i verden. Ved at kontrollere den rumlige orientering af propylen -byggestenene og yde
Katalysatorer for isotaktiske polære polypropylenerKredit: Angewandte Chemie International Edition Polypropylen (PP) er en af de mest anvendte plastmaterialer i verden. Ved at kontrollere den rumlige orientering af propylen -byggestenene og yde
- Team skaber 3-D-printede glukosebiosensorer
- Hvorfor en netto-nul fremtid afhænger af havenes evne til at absorbere kulstof
- Forskning viser målemodeller, der er effektive til at forudsige stormskader på trærammer
- Intet bevis for påvirkning af mørkt stof på kraften mellem kerner
- Mere end 1 million barrierer på Europas floder:undersøgelse
- Hvordan man identificerer Wild Cherry Trees


