Forskere bruger elektrokatalyse til stedspecifik proteinmodifikation
Boston College-forskere brugte en mild ladning af elektricitet til præcist at modificere proteiner, et nyt værktøj, der kan bruges til at udvikle nye bioterapeutika og proteinbaserede forskningsværktøjer, rapporterede holdet for nylig i tidsskriftet Nature Chemistry .
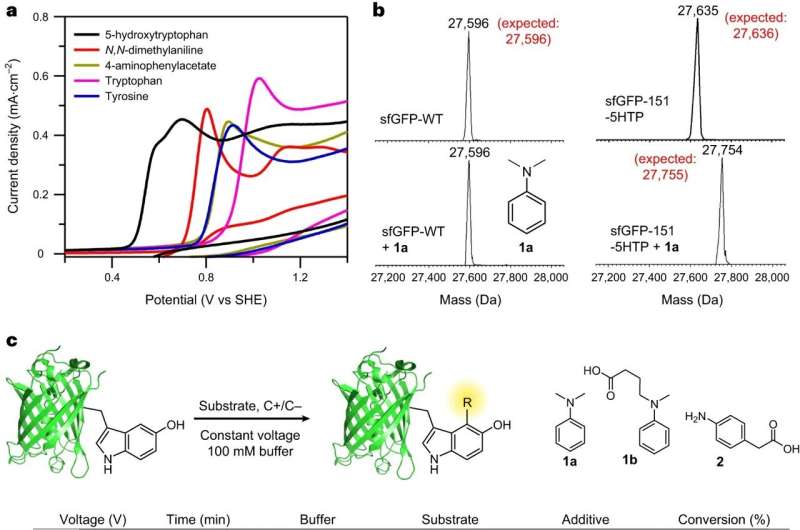
Holdet, ledet af BC professorer i kemi Abhishek Chatterjee og Eranthie Weerapana, udviklede og optimerede en ny elektrokemisk proteinmærkningsreaktion kaldet "eCLIC", der muliggør præcis modifikation af stedspecifikt inkorporerede 5-hydroxytryptophan (5HTP) rester på mange forskellige proteiner, inklusive fuld -længde terapeutiske antistoffer.
"Vi brugte denne strategi til at generere mange stedspecifikke proteinkonjugater, herunder et antistof-cytotoksisk lægemiddelkonjugat, der selektivt trænger ind i og dræber kræftceller, men ikke ikke-kræftceller," sagde Chatterjee. "En vigtig fordel ved eCLIC er, at de nødvendige reagenser til denne metode er virkelig billige og koster mindre end $10 pr. gram."
Holdets succes markerede første gang elektrokatalyse er blevet brugt til at opnå proteinmodifikation på en stedspecifik måde, rapporterede de i deres artikel "Elektrokemisk mærkning af hydroxyindoler med kemoselektivitet til stedspecifik proteinbiokonjugation."
Proteiner er store molekyler, typisk sammensat af hundredvis af aminosyremonomerer, bemærkede Chatterjee. Evnen til selektivt at modificere proteiner på foruddefinerede steder er vigtig for mange anvendelser. For eksempel, ved kovalent at binde toksiske lægemidler til antistoffer, har det været muligt selektivt at levere dem til cancerceller, hvilket resulterede i både forbedret terapeutisk effekt og reduceret off-target toksicitet.
Mange forskningsapplikationer kræver også vedhæftning af biofysiske prober til forskellige proteiner. Evnen til at definere stedet for modifikation på proteiner er afgørende for at sikre, at vigtige proteinfunktioner ikke skades, sagde Chatterjee.
"Udfordringen opstår fra det faktum, at alle proteiner er lavet af 20 aminosyrer i forskellige kombinationer," sagde han. "At identificere en modificerbar funktionalitet på det ønskede sted, som ikke gentages andre steder, er typisk udfordrende, hvilket gør det vanskeligt at opnå stedspecificitet i proteinmodifikation."
For at overvinde disse udfordringer søgte teamet at udvikle en metode til at inkorporere en ikke-naturlig aminosyre på ethvert udvalgt sted(er) af et protein. Holdet opnåede dette ved at omkonstruere oversættelsessystemet af celler til at rumme den nye aminosyre 5HTP.
Derudover ønskede forskerne at designe kemiske reaktioner, der kunne bruges til selektivt at modificere denne ikke-naturlige aminosyre i nærværelse af alle de naturlige aminosyrer, sagde Chatterjee.
"Hvis vi kunne gøre dette, kunne vi levere en generel metode til at generere proteiner med et indbygget 'vedhæftningshåndtag' på et foruddefineret sted. Især var vi interesserede i at udvikle en reaktion, der ville bruge elektricitet til at katalysere proteinmodifikationen reaktion i stedet for kemisk katalyse, da førstnævnte er billig, miljøvenlig og skånsom over for sarte proteiner."
Chatterjee sagde, at holdet var i stand til at overvinde en usædvanlig udfordring, da de første gang prøvede at modellere reaktionen. Typisk starter forskere med små molekyler, i dette tilfælde 5HTP og anilin, og går derefter videre til store proteiner.
Men de første forsøg på reaktionen mellem 5HTP og aniliner på niveauet med små molekyler var rodet, da 5HTP-molekylerne fortrinsvis reagerede med hinanden. Men da 5HTP blev inkorporeret i et stort protein, var det ikke længere i stand til at reagere med et andet proteinbundet 5HTP og reagerede rent med en anilin i stedet, rapporterede holdet.
"Hvis vi havde holdt fast i den traditionelle progression - fra lille til stor - ville vi aldrig have forfulgt eCLIC og tænkt 'det er for rodet'," sagde Chatterjee. "I stedet lavede vi vores reaktionsudvikling ikke-traditionelt, direkte på et protein, hvilket hjalp os med at indse, hvor rent og selektivt det var i disse omgivelser."
For yderligere at fremme eCLIC-strategien for storstilet modifikation af vigtige proteinmål, er denne teknologi blevet licenseret til BrickBio, Inc., som Chatterjee var med til at stifte. Fremtidig forskning vil fokusere på at udvikle næste generation, stedspecifikt modificeret proteinbaseret bioterapeutika og forskningsreagenser.
Flere oplysninger: Conor Loynd et al., Elektrokemisk mærkning af hydroxyindoler med kemoselektivitet til stedspecifik proteinbiokonjugation, Nature Chemistry (2023). DOI:10.1038/s41557-023-01375-y
Leveret af Boston College
Sidste artikelForskerhold designer små kemiske næser
Næste artikelKommunikation mellem rotorer i molekylær motor observeret for første gang
 Varme artikler
Varme artikler
-
 Ny sonde kunne hjælpe kirurger med at fjerne tumorer mere præcistBilledet viser et medlem af Prof OSheas forskerhold, Dr Dan Wu, Postdoc ved RCSI Institut for Kemi, hvem er den første forfatter på papiret. Kredit:Maxwell Photography En undersøgelse ledet af for
Ny sonde kunne hjælpe kirurger med at fjerne tumorer mere præcistBilledet viser et medlem af Prof OSheas forskerhold, Dr Dan Wu, Postdoc ved RCSI Institut for Kemi, hvem er den første forfatter på papiret. Kredit:Maxwell Photography En undersøgelse ledet af for -
 Kemisk brintlagringssystemKredit:Wiley Brint er en yderst attraktiv, men også stærkt eksplosiv energibærer, som kræver sikker, let og billig opbevaring samt transportsystemer. Forskere ved Weizmann Institute of Science, Is
Kemisk brintlagringssystemKredit:Wiley Brint er en yderst attraktiv, men også stærkt eksplosiv energibærer, som kræver sikker, let og billig opbevaring samt transportsystemer. Forskere ved Weizmann Institute of Science, Is -
 Forskere skaber ikke-psykedeliske forbindelser med samme antidepressive effektRepræsentation af serotonin 2A-receptoren (5HT2AR) signalerende proteinkompleks bundet til den nye forbindelse R-69 (i undergruppe, magenta). Kredit:Roth Lab, UNC School of Medicine Selvom det er u
Forskere skaber ikke-psykedeliske forbindelser med samme antidepressive effektRepræsentation af serotonin 2A-receptoren (5HT2AR) signalerende proteinkompleks bundet til den nye forbindelse R-69 (i undergruppe, magenta). Kredit:Roth Lab, UNC School of Medicine Selvom det er u -
 Strålingsdetekterende plastik får ingrediens til at forblive i det klareNick Myllenbeck, en materialeforsker ved Sandia National Laboratories, undersøger glødende plastik, der bruges til at detektere radioaktivt materiale. Kredit:Lloyd Wilson Forskere ved Sandia Natio
Strålingsdetekterende plastik får ingrediens til at forblive i det klareNick Myllenbeck, en materialeforsker ved Sandia National Laboratories, undersøger glødende plastik, der bruges til at detektere radioaktivt materiale. Kredit:Lloyd Wilson Forskere ved Sandia Natio
- Forskere finder kulstofrigt flydende vand i gammel meteorit
- Familier fra 8 lande sagsøger EU over klimaændringer
- Hvordan kan du demonstrere loven om bevarelse af masse for smeltende is?
- Sådan skæres agates
- Ny rapport tager et dybtgående kig på tre faktorer, der bidrager til stigning i havniveauet langs …
- Forskere udvikler en biologisk nedbrydelig legering til knogleimplantater til frakturer, osteoporose…


