Thianthrenium-kemi muliggør reaktivitetsskift af en nukleofil aminosyre til et alsidigt mellemprodukt
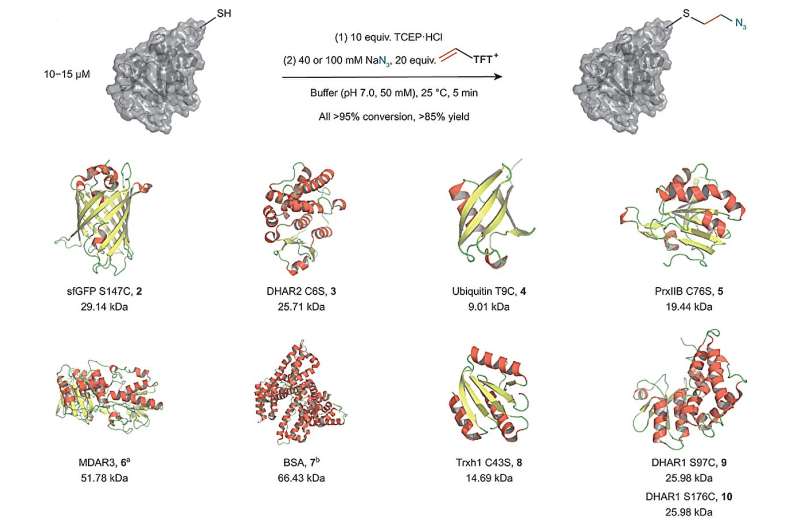
Kemisk diversificering af proteiner er et vigtigt begreb i studiet af biologiske processer og selve proteinernes komplekse strukturer. Forskere fra Max Planck Society har nu offentliggjort deres fascinerende resultater vedrørende en aminosyre i Nature Chemistry .
Kemisk diversificering af proteiner involverer brug af hurtige og milde reaktioner, der selektivt retter sig mod en specifik aminosyre og derfor en byggesten af proteiner. Cystein er et fremtrædende eksempel og kan i øjeblikket modificeres på to måder. Den første måde kræver syntese af elektrofiler for hver ønsket modifikation, f.eks. en fluorescensprobe, der gør det muligt at følge molekylet i meget komplekse biologiske blandinger.
Den anden måde forvandler selve cystein til et kemisk led, som derefter kan diversificeres. Indtil nu er dette blevet udført i flertrinssynteser. Disse metoder har den ulempe, at bindestiften ikke kan indføres i nærværelse af eksterne reagenser, der er nødvendige for dens diversificering. Det er ofte ledsaget af et begrænset udvalg af reagenser til funktionaliseringen, da knudepunktet skal forblive i opløsning under oprensningsprocesser og derfor har en iboende nedsat reaktivitet.
En ny teknik fra Tobias Ritters forskergruppe, direktør ved Max-Planck-Institut für Kohlenforschung, er spændende, fordi den muliggør introduktionen af et meget reaktivt mellemprodukt i en one-pot-proces baseret på en enkelt elektrofil. Derudover giver denne metode mulighed for en bred diversificering af det nye mellemprodukt, selv i nærvær af eksterne reagenser.
I deres undersøgelse fandt Ritter-gruppen en måde at bruge vinylthianthreniumsalte til at omdanne cystein til en meget reaktiv episulfoniumelektrofil in situ. Denne tilgang gør det muligt at forbinde cystein med forskellige andre eksterne nukleofiler i en enkelt one-pot proces uden behov for yderligere trin. Metoden gør det muligt for forskerne at knytte forskellige biorelevante funktionelle grupper til proteiner ved hjælp af en kort og stabil ethylenbinding meget tæt på proteinets overflade. Derfor giver det en ny og attraktiv måde at tilføje etiketter eller funktionaliteter, der ændrer det kemiske miljø af et protein.
Når der ikke er tilføjet eksterne nukleofiler, kan andre aminosyrer reagere med episulfonium-mellemproduktet i en intramolekylær reaktion. Denne reaktivitet muliggør protein-protein ligering og makrocyklisering af lineære peptider. Mens den første tilgang gør det muligt at studere proteinkomplekser og deres ofte ændrede biologiske aktivitet, gør den anden tilgang peptiderne mere stabile over for biologisk nedbrydning, hvis de f.eks. bruges som lægemiddel.
Derudover tillod syntesen af vinylthianthreniumsalte fra ethylengas Ritter-gruppen til at syntetisere reagenser med en anden sammensætning af isotoper. Disse isotopmærkede forbindelser har samme reaktivitet som de ikke-mærkede derivater, men afviger en smule i deres molekylvægt. Derfor kan de bruges i state-of-the-art massespektrometri proteomik forskning til at udtrække kvantitativ information fra hele cellulære systemer. Samlet set er metoden med vinylthianthreniumsalte fremvist som et nyttigt og bredt anvendeligt værktøj inden for kemisk biologi.
Flere oplysninger: Philipp Hartmann et al., Kemoselektiv ompolering af thioler til episulfonier til cysteinbiokonjugation, Nature Chemistry (2023). DOI:10.1038/s41557-023-01388-7
Journaloplysninger: Naturkemi
Leveret af Max Planck Society
 Varme artikler
Varme artikler
-
 Hybride enzymkatalysatorer syntetiseret ved en de novo tilgang til udvidelse af biokatalyseKredit:Chinese Journal of Catalysis De to store udfordringer i industriel enzymatisk katalyse er det begrænsede antal kemiske reaktionstyper, der katalyseres af enzymer og ustabilitet af enzymer u
Hybride enzymkatalysatorer syntetiseret ved en de novo tilgang til udvidelse af biokatalyseKredit:Chinese Journal of Catalysis De to store udfordringer i industriel enzymatisk katalyse er det begrænsede antal kemiske reaktionstyper, der katalyseres af enzymer og ustabilitet af enzymer u -
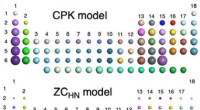 Visualisering af det usynlige:En ny model til at hjælpe med fortolkning af molekylære billeder i a…Det velkendte periodiske system af grundstoffer med hver slags atom vist som farvede kugler. Størrelsen af hvert atom i CPK-modellen (ovenfor) er større end dem i den Z-korrelerede model (nedenfor),
Visualisering af det usynlige:En ny model til at hjælpe med fortolkning af molekylære billeder i a…Det velkendte periodiske system af grundstoffer med hver slags atom vist som farvede kugler. Størrelsen af hvert atom i CPK-modellen (ovenfor) er større end dem i den Z-korrelerede model (nedenfor), -
 Ny måde at støde flåter af:Tør deres spyt opKredit:CC0 Public Domain Spyt fra en skovflåts bid kan overføre patogener, der forårsager alvorlige sygdomme, såsom Lyme sygdom, og betydelige landbrugstab. Nuværende insekticider har ulemper, så
Ny måde at støde flåter af:Tør deres spyt opKredit:CC0 Public Domain Spyt fra en skovflåts bid kan overføre patogener, der forårsager alvorlige sygdomme, såsom Lyme sygdom, og betydelige landbrugstab. Nuværende insekticider har ulemper, så -
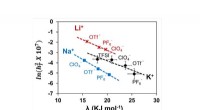 Ikke mere trial-and-error, når du vælger en elektrolyt til metal-luft-batterierDenne graf viser korrelationerne mellem tre parametre, der fører til en enkelt deskriptor, som giver et rationelt grundlag for at designe elektrolytsammensætninger til højeffekt alkalimetal-ilt-batter
Ikke mere trial-and-error, når du vælger en elektrolyt til metal-luft-batterierDenne graf viser korrelationerne mellem tre parametre, der fører til en enkelt deskriptor, som giver et rationelt grundlag for at designe elektrolytsammensætninger til højeffekt alkalimetal-ilt-batter
- Hvilken rolle spiller varme i kemiske reaktioner?
- Kunne nyligt spottede dunkle punktkilder forklare det galaktiske centeroverskud (GCE)?
- Vil klimaændringer lade tropiske fugle blive hængende til tørre?
- Ligesom tandpasta:Fluorid forbedrer radikalt stabiliteten af perovskit -solceller
- Intensifying Hurricane Lane undersøgt af GPM-satellit
- Ny katalysator forbedrer effektiviteten af lægemiddel- og pesticidproduktion


