Forskere identificerer dynamisk adfærd af nøgle SARS-CoV-2 tilbehørsprotein
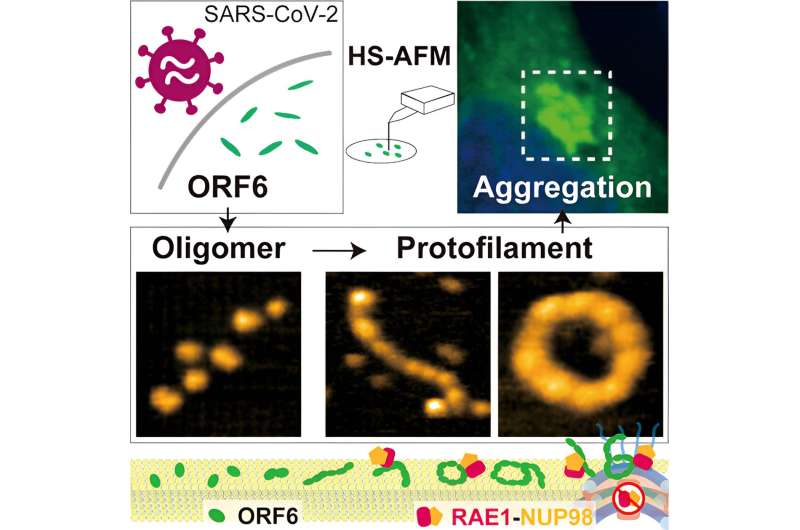
Forskere ved Kanazawa University rapporterer i Journal of Physical Chemistry Letters højhastigheds atomkraftmikroskopiundersøgelser, der kaster lys over den mulige rolle af proteinet med åben læseramme 6 (ORF6) i COVID-19-symptomer.
Mens mange lande over hele verden oplever en udsættelse fra den intense spredning af SARS-CoV-2-infektioner, der førte til tragiske niveauer af sygdom og flere nationale nedlukninger i begyndelsen af årtiet, fortsætter tilfælde af infektion.
En bedre forståelse af de mekanismer, der opretholder virussen i kroppen, kan hjælpe med at finde mere effektive behandlinger mod sygdom forårsaget af sygdommen, samt bevæbne sig mod fremtidige udbrud af lignende infektioner. Med dette i tankerne har der været stor interesse for de hjælpeproteiner, som virussen producerer for at hjælpe den med at trives i kroppen.
"I lighed med andre vira udtrykker SARS-CoV-2 en række hjælpeproteiner for at omprogrammere værtsmiljøet for at fremme dets replikation og overlevelse," forklarer Richard Wong ved Kanazawa University og Noritaka Nishida ved Chiba University og deres kolleger i denne seneste nyhed. rapport. Blandt disse hjælpeproteiner er ORF6.
Tidligere undersøgelser har antydet, at ORF6 interfererer med funktionen af interferon 1 (IFN-I), en særlig type lille protein, der bruges i immunsystemet, hvilket kan forklare tilfældene af asymptomatisk infektion med SARS-CoV2. Der er også bevis for, at ORF6 forårsager tilbageholdelse af visse proteiner i cytoplasmaet, mens den forstyrrer mRNA-transport fra cellen, hvilket kan være et middel til at hæmme IFN-I-signalering. Mekanismen for denne proteinretention og transportafbrydelse var imidlertid ikke klar.
For at kaste lys over disse mekanismer undersøgte forskerne først, hvilke spor forskellige softwareprogrammer kunne give til strukturen af ORF6. Disse indikerede den sandsynlige tilstedeværelse af flere iboende uordnede regioner. Kernemagnetiske resonansmålinger bekræftede også tilstedeværelsen af et meget fleksibelt uordnet segment.
Selvom maskinlæringsalgoritmen AlphaFold2 har vist sig meget nyttig til at bestemme, hvordan proteiner folder, begrænser tilstedeværelsen af disse iboende uordnede regioner dens anvendelse til at etablere strukturen af ORF6, så forskerne brugte højhastigheds atomkraftmikroskopi (HS-AFM), som er i stand til at identificere strukturer ved at detektere topografien af prøver, som en pladespillernål krydser rillerne i vinyl.
Ved hjælp af HS-AFM fastslog forskerne, at ORF 6 primært er i form af ellipsoide filamenter af oligomerer - strenge af gentagne molekylære enheder, men kortere end polymerer. Længden og omkredsen af disse filamenter var størst ved 37°C og mindst ved 4°C, så tilstedeværelsen af feber kunne være gavnlig til at producere større filamenter. Substrater lavet af lipider - fedtholdige forbindelser - fremmede også dannelsen af større oligomerer.
Fordi HS-AFM fanger billeder så hurtigt, var det muligt at forstå ikke kun strukturerne, men også nogle af dynamikken i ORF6-adfærden, herunder cirkulær bevægelse, proteinsamling og flipping. Derudover afslørede yderligere computeranalyse også, at filamenterne var tilbøjelige til at aggregere til amyloider, som findes i nogle neurodegenerative sygdomme, og som kan føre til komplikationer i COVID-19-symptomer. Som forskerne påpeger, virker denne aggregering "for effektivt at sekvestre et stort antal værtsproteiner, især transkriptionsfaktorer involveret i IFN-I-signalering."
Da disse filamenter går i stykker i nærværelse af visse alkoholer, urinstof eller natriumdodecylsulfat Wong, konkluderer Nishida og deres kolleger, at proteinet i vid udstrækning holdes sammen af hydrofobe interaktioner. "Potentielle lægemiddelkandidater, der adskiller ORF6-aggregater ved at forstyrre hydrofobe interaktioner, bør overvejes og testes i den nærmeste fremtid for at evaluere deres terapeutiske værdi i COVID-19-håndtering og -behandling," siger forskerne.
Flere oplysninger: Goro Nishide et al, Nanoscopic Elucidation of Spontaneous Self-Assembly of Severe Acute Respiratory Syndrome Coronavirus 2 (SARS-CoV-2) Open Reading Frame 6 (ORF6) Protein, The Journal of Physical Chemistry Letters (2023). DOI:10.1021/acs.jpclett.3c01440
Journaloplysninger: Journal of Physical Chemistry Letters
Leveret af Kanazawa University
 Varme artikler
Varme artikler
-
 Nye polymermaterialer gør fremstilling af optiske sammenkoblinger nemmereForskere bruger, hvad de kalder en SmartPrint-proces til at udvikle nye polymermaterialer. Kredit:Robert Norwood, University of Arizona Forskere har udviklet nye polymermaterialer, der er ideelle t
Nye polymermaterialer gør fremstilling af optiske sammenkoblinger nemmereForskere bruger, hvad de kalder en SmartPrint-proces til at udvikle nye polymermaterialer. Kredit:Robert Norwood, University of Arizona Forskere har udviklet nye polymermaterialer, der er ideelle t -
 Mikroskop, der detekterer individuelle vira, kunne drive hurtig diagnostikPRISM til COVID-19-detektion. Øverst, koncept kunst. Nederst til venstre, et mikroskopbillede af en enkelt virus på den fotoniske krystaloverflade. Nederst til højre, et PRISM-billede med seks virus o
Mikroskop, der detekterer individuelle vira, kunne drive hurtig diagnostikPRISM til COVID-19-detektion. Øverst, koncept kunst. Nederst til venstre, et mikroskopbillede af en enkelt virus på den fotoniske krystaloverflade. Nederst til højre, et PRISM-billede med seks virus o -
 Reducering af læderforurening med smeltede salteKredit:American Chemical Society Fra håndtasker og jakker til bilinteriør, læderprodukter er næsten overalt. Men behandling af læderet til disse luksusartikler skaber en masse potentielt skadelig
Reducering af læderforurening med smeltede salteKredit:American Chemical Society Fra håndtasker og jakker til bilinteriør, læderprodukter er næsten overalt. Men behandling af læderet til disse luksusartikler skaber en masse potentielt skadelig -
 Gør en god ting bedre:En syretest, der ikke vil drukne i vandMichigan Tech kemikere dyrkede levende celler under forskellige pH-forhold, behandlede dem med et nyt fluorescerende cyaninfarvestof og fangede deres billeder under forskellige lysfrekvenser, både syn
Gør en god ting bedre:En syretest, der ikke vil drukne i vandMichigan Tech kemikere dyrkede levende celler under forskellige pH-forhold, behandlede dem med et nyt fluorescerende cyaninfarvestof og fangede deres billeder under forskellige lysfrekvenser, både syn
- Sukkerholdige hemmeligheder af et kræftrelateret protein
- Automatiseret maskinlæringsrobot åbner op for nyt potentiale for genetisk forskning
- Sådan fodrer appelsiner til Wild Birds
- Atomdrevet missilulykke i Rusland:Hvad skete der egentlig?
- Bare tilsæt vand og behandle hjernekræft
- NASA-programmet giver eleverne adgang til astronauter


