Ny AI-model identificerer nye farmaceutiske ingredienser og forbedrer eksisterende

Nye aktive farmaceutiske ingredienser lægger grundlaget for innovative og bedre medicinske behandlinger. Men at identificere dem og frem for alt producere dem gennem kemisk syntese i laboratoriet er ingen ringe bedrift. For at finde ud af den optimale produktionsproces bruger kemikere normalt en trial-and-error-tilgang:de udleder mulige metoder til laboratoriesyntese fra kendte kemiske reaktioner og tester derefter hver enkelt med eksperimenter, en tidskrævende tilgang, der er fyldt med blindgyder .
Nu har forskere ved ETH Zürich sammen med forskere fra Roche Pharma Research and Early Development fundet frem til en tilgang baseret på kunstig intelligens, der hjælper med at bestemme den bedste syntesemetode, herunder dens sandsynlighed for succes. Deres papir er offentliggjort i tidsskriftet Nature Chemistry .
"Vores metode kan i høj grad reducere antallet af nødvendige laboratorieeksperimenter," forklarer Kenneth Atz, der udviklede AI-modellen som ph.d.-studerende sammen med professor Gisbert Schneider ved Institute of Pharmaceutical Sciences ved ETH Zürich.
Aktive farmaceutiske ingredienser består normalt af et stillads, hvorpå der er bundet såkaldte funktionelle grupper. Det er disse, der giver stoffet dets meget specifikke biologiske funktion. Stilladsets opgave er at bringe funktionsgrupperne i en defineret geometrisk opstilling, så de kan agere målrettet. Forestil dig et kranbyggesæt, hvor et stel af forbindelseselementer er boltet sammen på en sådan måde, at funktionelle samlinger som ruller, kabelspil, hjul og førerkabine er arrangeret korrekt i forhold til hinanden.
Introduktion af kemiske funktioner
En måde at fremstille lægemidler med en ny eller forbedret medicinsk effekt på er at placere funktionelle grupper på nye steder på stilladserne. Dette lyder måske simpelt, og det ville bestemt ikke udgøre et problem på en modelkran, men det er særligt svært i kemi. Dette skyldes, at stilladserne, der primært består af kulstof- og brintatomer, i sig selv er praktisk talt ikke-reaktive, hvilket gør det vanskeligt at binde dem med funktionelle atomer som oxygen, nitrogen eller klor. For at dette skal lykkes, skal stilladserne først aktiveres kemisk via omvejsreaktioner.
En aktiveringsmetode, der åbner rigtig mange muligheder for forskellige funktionelle grupper, i hvert fald på papiret, er borylering. I denne proces er en kemisk gruppe, der indeholder grundstoffet bor, bundet til et kulstofatom i stilladset. Borgruppen kan så simpelthen erstattes af en lang række medicinsk effektive grupper.
Data fra troværdige kilder og et automatiseret laboratorium
"Selvom borylering har et stort potentiale, er reaktionen svær at kontrollere i laboratoriet. Derfor har vores omfattende søgning i den verdensomspændende litteratur kun fundet godt 1.700 videnskabelige artikler om emnet," siger Atz og beskriver udgangspunktet for sit arbejde.
Ideen var at tage reaktionerne beskrevet i den videnskabelige litteratur og bruge dem til at træne en AI-model, som forskerholdet derefter kunne bruge til at overveje nye molekyler og identificere så mange steder som muligt på dem, hvor borylering ville være mulig. Men i sidste ende fodrede forskerne deres model kun med en brøkdel af den litteratur, de fandt. For at sikre, at modellen ikke blev vildledt af falske resultater fra skødesløs forskning, begrænsede holdet sig til 38 særligt troværdige papirer. Disse beskrev i alt 1.380 boryleringsreaktioner.
For at udvide træningsdatasættet supplerede holdet litteraturresultaterne med evalueringer af 1.000 reaktioner udført i det automatiserede laboratorium, der drives af Roches medicinske kemiske forskningsafdeling. Dette gør det muligt at udføre mange kemiske reaktioner på milligramskalaen og analysere samtidigt.
"At kombinere laboratorieautomatisering med AI har et enormt potentiale til i høj grad at øge effektiviteten i kemisk syntese og forbedre bæredygtigheden på samme tid," siger David Nippa, en ph.d.-studerende fra Roche, som gennemførte projektet sammen med Atz.
Høj forudsigelsesevne, især med 3D-data
De forudsigelige egenskaber af modellen genereret fra denne datapulje blev verificeret ved hjælp af seks kendte lægemiddelmolekyler. I 5 ud af 6 tilfælde bekræftede eksperimentel test i laboratoriet de forudsagte yderligere steder. Modellen var lige så pålidelig, når det kom til at identificere steder på stilladset, hvor aktivering ikke er mulig. Hvad mere er, det bestemte de optimale betingelser for aktiveringsreaktionerne.
Interessant nok blev forudsigelserne endnu bedre, da 3D-information om udgangsmaterialerne blev inkluderet i stedet for blot deres todimensionelle kemiske formler. "Det ser ud til, at modellen udvikler en slags tredimensionel kemisk forståelse," siger Atz.
Succesraten for forudsigelserne imponerede også forskerne ved Roche Pharma Research and Early Development. I mellemtiden har de med succes brugt metoden til at identificere steder i eksisterende lægemidler, hvor yderligere aktive grupper kan introduceres. Dette hjælper dem med at udvikle nye og mere effektive varianter af kendte aktive farmaceutiske ingredienser hurtigere.
Sæt på andre aktiveringer og funktionaliseringer
Atz og Schneider ser adskillige andre mulige anvendelser for AI-modeller, der er baseret på en kombination af data fra troværdig litteratur og fra eksperimenter udført i et automatiseret laboratorium. For eksempel burde denne tilgang gøre det muligt at skabe effektive modeller for andre aktiveringsreaktioner end borylering. Holdet håber også at identificere en bredere række af reaktioner til yderligere funktionalisering af de borylerede steder.
Atz er nu involveret i dette videre udviklingsarbejde som AI-forsker i medicinsk kemi-forskning hos Roche. "Det er meget spændende at arbejde i grænsefladen mellem akademisk AI-forskning og laboratorieautomatisering. Og det er en fornøjelse at kunne drive dette fremad med det bedste indhold og de bedste metoder," siger Atz.
Schneider tilføjer:"Dette innovative projekt er endnu et fremragende eksempel på samarbejde mellem den akademiske verden og industrien og demonstrerer det enorme potentiale i offentlig-private partnerskaber for Schweiz."
Flere oplysninger: David F. Nippa et al., Muliggørelse af lægemiddeldiversificering i det sene stadie ved eksperimentering med høj gennemstrømning med geometrisk dyb læring, Nature Chemistry (2023). DOI:10.1038/s41557-023-01360-5
Journaloplysninger: Naturkemi
Leveret af ETH Zürich
 Varme artikler
Varme artikler
-
 Hårde magnetiske belægninger til højpræcisionsmikroskopiMikroskopplade med magnetisk positionering. Kredit:ITK Dr. Kassen GmbH Mikroskopi er i spidsen for kampen mod coronavirus. Specielle mikroskoper, som gør det muligt for forskere at se små cellestr
Hårde magnetiske belægninger til højpræcisionsmikroskopiMikroskopplade med magnetisk positionering. Kredit:ITK Dr. Kassen GmbH Mikroskopi er i spidsen for kampen mod coronavirus. Specielle mikroskoper, som gør det muligt for forskere at se små cellestr -
 Forskere finder værdi i usædvanlig type plantematerialeKredit:CC0 Public Domain Et ideelt bioraffinaderi ville forvandle vedvarende afgrøder til en række forskellige brændstoffer og produkter med lidt affald. En væsentlig udfordring i at realisere den
Forskere finder værdi i usædvanlig type plantematerialeKredit:CC0 Public Domain Et ideelt bioraffinaderi ville forvandle vedvarende afgrøder til en række forskellige brændstoffer og produkter med lidt affald. En væsentlig udfordring i at realisere den -
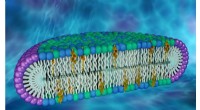 Ny cellemembranmodel kan være nøglen til at afdække nye proteinegenskaberForskere brugte neutron- og røntgenspredningsteknikker ved Oak Ridge og Brookhaven National Laboratories til at karakterisere skiveformede strukturer, kendt som biceller, der efterligner cellemembrane
Ny cellemembranmodel kan være nøglen til at afdække nye proteinegenskaberForskere brugte neutron- og røntgenspredningsteknikker ved Oak Ridge og Brookhaven National Laboratories til at karakterisere skiveformede strukturer, kendt som biceller, der efterligner cellemembrane -
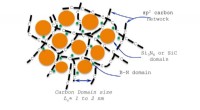 Ingeniøren patenterer vandlignende polymer for at skabe keramik ved høj temperaturDenne grafik viser strukturen af en keramik fremstillet af en Kansas State University-patenteret vandlignende polymer. Keramikken har en tilfældig struktur, der giver stabilitet ved høje temperature
Ingeniøren patenterer vandlignende polymer for at skabe keramik ved høj temperaturDenne grafik viser strukturen af en keramik fremstillet af en Kansas State University-patenteret vandlignende polymer. Keramikken har en tilfældig struktur, der giver stabilitet ved høje temperature
- Hvordan virker Weathering?
- Udvikling af multifunktionelle kompositmaterialer til rumfartsapplikationer
- Højeste havvandstemperatur nogensinde registreret på Scripps Pier
- Venturekapital ser ud til at være i fuld udbredelse men er det for meget snart?
- Dybt i hjertet af vores galakse,
- Forskerholdet sigter mod at reducere omkostningerne ved lægemiddeludvikling ved hjælp af 3-D-print…


