Nyløst struktur afslører, hvordan celler modstår iltskader
ROS, såsom superoxid og hydrogenperoxid, produceres som naturlige biprodukter af cellulær metabolisme, og når celler udsættes for eksterne stressfaktorer som stråling og toksiner. Mens ROS spiller en rolle i cellulær signalering og immunitet, kan for høje niveauer forårsage oxidativ stress og beskadige proteiner, lipider og DNA, hvilket fører til celledød og forskellige sygdomme.
En af de primære forsvarsmekanismer mod oxidativ skade involverer antioxidantenzymer såsom superoxiddismutaser (SOD'er). Især er mangansuperoxiddismutase (MnSOD), placeret i mitokondriematrixen, et kritisk enzym, der katalyserer omdannelsen af superoxidradikalet til hydrogenperoxid og oxygen.
På trods af vigtigheden af MnSOD til at beskytte celler mod oxidativ skade, forblev den detaljerede molekylære mekanisme, hvormed den udfører denne funktion, uklar. For at afsløre disse hemmeligheder satte et internationalt hold af forskere ledet af forskere fra RIKEN Center for Sustainable Resource Science (CSRS) og Institute of Molecular Biology and Genetics (IMBG) sig for at bestemme strukturen af menneskelig MnSOD.
Ved hjælp af state-of-the-art kryo-elektronmikroskopi-teknikker visualiserede forskerne strukturen af menneskelig MnSOD med en opløsning på 2,8 Å. Denne højopløsningsstruktur afslørede det præcise arrangement af proteinets atomer og gav en detaljeret forståelse af dets molekylære arkitektur.
Forskerne fandt ud af, at menneskelig MnSOD danner en homotetramerisk struktur med fire identiske underenheder arrangeret i en tetraedrisk form. Denne organisation skaber et aktivt sted ved grænsefladen af hvert par af underenheder, hvor superoxidomdannelsesreaktionen finder sted.
Ydermere afslørede strukturen en fleksibel løkkeregion nær det aktive sted, der undergår konformationelle ændringer ved substratbinding. Denne konformationsændring gør det muligt for proteinet effektivt at fange superoxidmolekyler og katalysere deres omdannelse, hvilket forbedrer dets beskyttende funktion mod oxidativt stress.
Resultaterne fra denne undersøgelse giver vigtig indsigt i den molekylære mekanisme af MnSOD til at beskytte celler mod oxidativ skade. Forståelse af disse strukturelle og mekanistiske detaljer kan bane vejen for udviklingen af nye terapeutiske strategier til at øge cellulær modstand mod oxidativ stress og bekæmpe oxidativ stress-relaterede sygdomme.
Undersøgelsen, med titlen "Cryo-EM-struktur af human mangansuperoxiddismutase afslører den molekylære mekanisme for superoxidomdannelse," blev offentliggjort i tidsskriftet Nature Communications.
Sidste artikelHvordan opstod kemiske bestanddele, der er nødvendige for liv, på den primitive jord?
Næste artikelPulvere viser deres styrke
 Varme artikler
Varme artikler
-
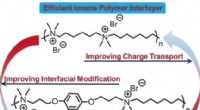 Fullerener bygger bro over ledende kløft i organisk fotovoltaikKredit:Wiley Organisk solceller har opnået bemærkelsesværdigt høje effektiviteter, men at finde optimale kombinationer af materialer til højtydende organiske solceller, som også er økonomisk konku
Fullerener bygger bro over ledende kløft i organisk fotovoltaikKredit:Wiley Organisk solceller har opnået bemærkelsesværdigt høje effektiviteter, men at finde optimale kombinationer af materialer til højtydende organiske solceller, som også er økonomisk konku -
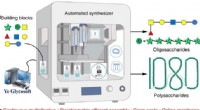 Automatisk kulhydratsynthesizer producerer polysaccharider af rekordlængdeGrafisk abstrakt. Kredit:Nature Synthesis (2022). DOI:10.1038/s44160-022-00171-9 Et team af forskere med medlemmer fra Peking University og WuXi AppTec (Tianjin) Co., Ltd., har designet og bygget e
Automatisk kulhydratsynthesizer producerer polysaccharider af rekordlængdeGrafisk abstrakt. Kredit:Nature Synthesis (2022). DOI:10.1038/s44160-022-00171-9 Et team af forskere med medlemmer fra Peking University og WuXi AppTec (Tianjin) Co., Ltd., har designet og bygget e -
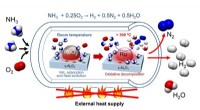 Katalysator til kulstoffri produktion af brintgas fra ammoniakKredit:Katsutoshi Nagaoka (Phys.org)—Hydrogen har potentialet til at give et alternativ, ren energikilde, især når det gælder brændselscelleteknologi. Nuværende brændstofkilder involverer kulstofh
Katalysator til kulstoffri produktion af brintgas fra ammoniakKredit:Katsutoshi Nagaoka (Phys.org)—Hydrogen har potentialet til at give et alternativ, ren energikilde, især når det gælder brændselscelleteknologi. Nuværende brændstofkilder involverer kulstofh -
 Flamme på! Hvordan AI kan tæmme en kompleks materialeteknik og transformere fremstillingJoseph Libera og Anthony Stark forbereder sig til in-situ Raman-spektroskopi. Kredit:Argonne National Laboratory Oprettelse af nanomaterialer med flammespraypyrolyse er kompleks, men forskere ved
Flamme på! Hvordan AI kan tæmme en kompleks materialeteknik og transformere fremstillingJoseph Libera og Anthony Stark forbereder sig til in-situ Raman-spektroskopi. Kredit:Argonne National Laboratory Oprettelse af nanomaterialer med flammespraypyrolyse er kompleks, men forskere ved


